АННОТАЦИЯ
Процесс клинического лабораторного исследования включает три этапа: преаналитический, аналитический и постаналитический. Несмотря на то, что частота аналитических ошибок в клинических лабораториях существенно снизилась за счет автоматизации и современных технологий, ошибки, связанные с преаналитическим и постаналитическим этапами остаются значительными и требуют внимания специалистов по лабораторной медицине к тому, что происходит за пределами лаборатории. В интересах пациентов необходимо рассматривать любые прямые и косвенные негативные последствия, связанные с лабораторными исследованиями, независимо от того, на каком этапе возникает ошибка.
Введение. Клиническая безопасность пациента определяется правильной и своевременной диагностикой патологии и применением адекватных лечебных мероприятий (при минимальных побочных действиях) с целью достижения благополучного исхода случая заболевания [1] .
Согласно литературным данным на основе результатов лабораторных исследований принимаются до 60-70% клинических решений относительно диагноза заболевания и тактики лечения [2-4].
Как отмечает в своей публикации Меньшиков В.В., «процесс клинического лабораторного исследования – от решения врача назначить анализ до получения им результата анализа – проходит три этапа, в которых соответствующие процедуры выполняет несколько участников. Задача всех участников процесса заключается в том, чтобы как можно меньше изменить состав взятого у пациента образца и в результате анализа отразить с наибольшей точностью те его содержание и свойства, которыми обладает этот материал в организме пациента, и правильно интерпретировать результат, с тем, чтобы получить достоверную лабораторную информацию.
На всех этапах лабораторного процесса могут возникнуть отклонения, приводящие к ошибочному итогу – не вполне достоверной информации».
Автор демонстрирует следующий рисунок этапов клинического лабораторного исследования: до лабораторный, лабораторный и после лабораторный (рисунок 1)
В литературе встречаются и другие названия этапов лабораторного процесса: преаналитический, аналитический и постаналитический.
Следовательно, ошибки, связанные с проведением лабораторных исследований могут быть обусловлены многими причинами на различных этапах проведения: назначением лабораторного теста, не соответствующего клинической задаче; нарушением условий взятия образца биоматериала, его хранения, предварительной обработки и транспортировки; недостаточной квалификацией оператора; недостаточным учетом влияний биологической, ятрогенной, аналитической вариации при оценке результата исследования; неудовлетворительной нозологической интерпретацией результата исследования; задержкой передачи информации о критических изменениях лабораторных показателей и др. Целый комплекс факторов, которые могут оказывать существенное влияние на качество результатов анализов, находится в компетенции врачей-клиницистов и среднего медицинского персонала. Изучение этих факторов будет способствовать обеспечению качества результатов лабораторных исследований.
Целью данного обзора является изучение типов и частоты ошибок в лабораторной медицине на основе анализа международной научной литературы.
Материалы и методы. Были изучены результаты научных исследований в области лабораторной медицины за последние 10 лет. Поиск научных публикаций проводился в базах данных PubMed, Oxford University Press, Google Scholar.
Результаты. Проблема ошибок в клинической лаборатории в последнее время привлекает большое внимание, так как играет ключевую роль для медицинских услуг и может создавать серьезный риск, влияющий на жизнь пациента. Частота лабораторных ошибок значительно варьируется в зависимости от процедур диагностики и этапов всего процесса тестирования [5].
Как отмечают авторы, «частота аналитических ошибок в клинических лабораториях существенно снизилась за последние годы в результате активного движения за безопасность пациентов и внедрения передовых технологий в проведение лабо-

раторных тестов. Однако, по сравнению с медицинскими ошибками других типов, ошибкам в лабораторной медицине уделяется мало внимания. Ошибки в лабораторной медицине трудноопределимы, поскольку их трудно идентифицировать и, даже после обнаружения, понять их причину сложнее, чем в случае медицинских ошибок другого типа. Если сравнивать с неблагоприятными исходами, вызванными хирургическим и другими, зачастую совершенно очевидными, ошибками, совершенными в ходе лечения, лабораторные ошибки имеют тенденцию быть менее явными, указать время и место их совершения непросто» [6].
Традиционно процесс клинического лабораторного исследования подразделяется на 3 этапа:
- — преаналитический этап (назначение определенного исследования, взятие образца биоматериала, его предварительная обработка, хранение и транспортировка к месту проведения собственно анализа);
- — аналитический этап (идентификация образца биоматериала, необходимая обработка для получения аналитической пробы, применение аналитической технологии с использованием соответствующих реагентов и оборудования, получение описательного или количественного результата исследования);
- — постаналитический этап (оценка аналитической, биологической, клинической достоверности результата исследования, его нозологическая интерпретация, доставка результата назначившему исследование персоналу, хранение образца и результатов исследования в условиях и в течение сроков, установленных применительно к данному виду исследования и клинической задаче).
Большинство ошибок происходит на пре- и постаналитическом этапах (таблицы 1,2) [7]. Что касается аналитического этапа, то Lippi и коллеги опубликовали, что общий коэффициент ошибок в процессе тестирования широко варьируется от 0,1% до 3,0% [8]. В исследованиях, проведенных Plebani M., Carraro P., уровень лабораторных ошибок за 10 лет снизился с 0,47% в 1977 году до 0,33% в 2007 году [9-10]. Согласно другим литературным данным (Belk and Sunderman, 1947; Witte, 1997) за период с 1947 по 1997 гг. частота ошибок аналитического этапа снизилась с 162116 на миллион лабораторных тестов (part per million, ppm) до 447 ppm [11-12].
Это произошло благодаря автоматизации, усовершенствованию лабораторных технологий, стандартизации анализа, использованию тщательно разработанных правил внутреннего контроля и эффективных схем обеспечения качества, а также благодаря повышению уровня подготовки персонала.
Однако неудовлетворительное качество остается при выполнении и оценке стандартных клинических биохимических и коагуляционных тестов, гематологических и молекулярно-биологических тестов. В частности, относительно высокая частота аналитических ошибок и связанных с ними неблагоприятных клинических последствий была задокументирована при выполнении иммунохимических исследований.
Таблица 1. Частота встречаемости и типы ошибок на различных этапах аналитического процесса (Mario Plebani, 2007)
|
Типы ошибок |
1996 год |
2000 год |
||
|
ppm |
% |
ppm |
% |
|
|
Общее количество ошибок |
4667 |
100 |
3092 |
100 |
|
Преаналитических |
3186 |
68,3 |
1914 |
61,9 |
|
Аналитических |
617 |
13,2 |
463 |
15,0 |
|
Постаналитических |
864 |
18,5 |
715 |
23,1 |
Таблица 2. Типы ошибок и их частота на различных этапах всего аналитического процесса (Mario Plebani, 2010).
|
Этап общего аналитического процесса |
Тип ошибки |
Относительная частота (%) |
|
Пре-преаналитический |
Ошибка при выборе тестов Ошибка при составлении заявки Неверная идентификация пациентов/ образцов Использование образцов, собранных из канала инфузии Ошибка при сборе образцов (гемолиз, свертывание, недостаточный объем, и т.д.) Использование неподходящей емкости Обращение, хранение и транспортировка |
46,0-68,2% |
|
Преаналитический |
Неправильная сортировка и пересылка образцов Проливание образцов Ошибка при аликвотировании, пипетировании и маркировке Ошибка при центрифугировании (неверное время и/или скорость) |
3,0-5,3% |
|
Аналитический |
Неисправность оборудования Анализ не того образца Интерференция (эндогенная и экзогенная) Невыявленная ошибка контроля качества |
7,0-13,0% |
|
Постаналитический |
Ошибочная валидация данных анализа Несообщение результатов/ передача результатов не тому адресату Слишком большое общее время анализа Неправильный ввод данных и ошибка при записи данных от руки Несообщение/задержка в сообщении о критических значениях |
12,5-20,0% |
|
Пост- постаналитический |
Запоздалая реакция/Отсутствие реакции на лабораторный отчет Неверная интерпретация Неподходящий/неадекватный план диспансерного наблюдения Неназначение необходимой консультации |
25,0-45,5% |
В исследовании, проведенном Laposata M., Dighe A. [13], было установлено, что неправильная интерпретация диагностических и лабораторных тестов врачом, а также неинформирование амбулаторных больных о клинически значимых аномальных результатах, являются довольно широко распространенным явлением, примерно один случай на каждые 14 тестов. Примеры включают пациентов, которых не проинформировали о высоком уровне общего холестерина (8,2 ммоль/л, 318 мг/ дл), низком гематокрите (28,6%) и низком уровне калия (2,6 ммоль/л). Общее количество случаев, когда пациенту не была передана информация или факт передачи информации не был задокументирован, составило 7,1%, а диапазон таких случаев в разных учреждениях от 0% до 26%. Такая ситуация противоречит принципу «солидарной ответственности» и «совместного принятия решения», в рамках которых врач предоставляет пациенту и его семье всю клиническую информацию, включая результаты лабораторных исследований.
Вероятность неблагоприятных последствий лабораторных ошибок и назначения неадекватного лечения варьирует от 2,7% до 12%, но большая доля лабораторных ошибок (от 24,4% до 30%) отвечает за возникновение дополнительных проблем, не сказывающихся прямо на здоровье пациента. В исследованиях сообщается, что ошибки приводили к неадекватному помещению пациентов в отделение интенсивной терапии, ненужному переливанию крови, неверному изменению терапии гепарином и дигоксином. Влияние лабораторных ошибок на дальнейший клинический путь пациента – речь идет о дополнительных ненужных исследованиях (лабораторных, рентгенографических, томографических и т.п.), более инвазивных методах анализа, дополнительных консультациях – гораздо существеннее и, хотя не обязательно причиняет вред, однако доставляет лишнее беспокойство и ведет к дополнительным расходам, как для пациента, так и для системы здравоохранения [14].
Интерес представляют результаты исследования, проведенного в Республике Башкортостан [15]. Данные были собранны из 37 лабораторий медицинских организаций г.Уфы и Республики Башкортостан. Проводился опрос специалистов клинико-диагностических лабораторий государственных медицинских организаций и коммерческих лабораторий, включая заведующих (n=37), биологов (n=351), врачей КДЛ (n=112) по разработанной анкете, которая включала в себя 30 вопросов, касающихся организации работы на преана- литическом этапе лабораторного процесса. Исследования показали, что одной из самых распространенных ошибок на данном этапе является необоснованное назначение лабораторного обследования.
По мнению ряда авторов, на преана- литической фазе происходит большинство лабораторных ошибок [16-20]. В докладе Бонини и его коллег было установлено, что в лаборатории преобладали преданалити- ческие ошибки, варьирующиеся от 31,6% до 75% [21].
В 2008-2009 годах Chawla R. с соавторами определили, что для стационарных больных уровень преаналитической ошибки составил 1,9% (наибольшую частоту составил гемолиз образца – 1,1%), для амбулаторных больных частота ошибок составляла 1,2% (переменная с наивысшей частотой была необоснованность тестирования) [22]. Специалистами было выявлено четырнадцать различных причин преданалитической ошибки, наиболее распространенными из которых были ошибки при заполнении пробирки и идентификации пациента [23- 26].
Заключение. Согласно отчету исследователей из Медицинской школы Университета Джона Хопкинса в Балтиморе, медицинская ошибка является третьей по значимости причиной смерти в США [27]. Безопасность пациентов остается проблемой во многих областях здравоохранения, и лабораторная медицина может стать лидером в снижении ошибок [28].
Содействие эффективному контролю качества и постоянному совершенствованию всего процесса тестирования, включая пре- и постаналитические фазы, является необходимым условием для эффективного лабораторного обслуживания. Медицинские ошибки больше нельзя рассматривать как неизбежные, необходимо их активно оптимизировать и предотвращать [29-30].
СПИСОК ЛИТЕРАТУРЫ
- Меньшиков В.В. Клиническая безопасность пациента и достоверность лабораторной информации (лекция) // Клиническая лабораторная диагностика. -2013. -№6.
- Jordan B., Mitchell C., Anderson A., Farkas N., Batrla R. The Clinical and Health Economic Value of Clinical Laboratory Diagnostics // EJIFCC.-2015.-26(1). -Р.47–62.
- Frank H. Wians. Clinical Laboratory Tests: Which, Why, and What Do The Results Mean? // Laboratory Medicine.-2009.-Volume 40.-Issue 2. -P.105–113.
- Бражникова О.В., Гавеля Н.В., Майкова И.Д. Типичные ошибки на преаналити- ческом этапе проведения лабораторных исследований // Педиатрия. Приложение к журналу Consilium Medicum. -2017. -№4.
- Eng. Wafa’ Al-faraeh, Eng. Mohamed F. Ababeneh. The detection and prevention of errors in Clinical laboratory //International Journal of Scientific and Research Publications.- 2018.-Volume 8, Issue 11.-P.480-486.
- Mario Plebani. Выявление и предотвращение ошибок в лабораторной медицине// Annals of Clinical Biochemistry. -№ 47. -2010.-С. 101-110.
- Plebani M. Laboratory errors: How to improve pre- and post-analytical phases? // Biochem Med. -2007; 17:5-9.
- Lippi G., Plebani M., Šimundić A.M. Quality in laboratory diagnostics: From theory to practice //Biochem Med. -2010; 20:126-130.
- Plebani M., Carraro P. Mistakes in a stat laboratory: Types and frequency//Clin Chem. -1997; 43:1348-1351.
- Carraro P., Plebani M. Errors in a stat laboratory: Types and frequencies 10 years later //Clin Chem. -2007; 53:1338-1342.
- Belk WP, Sunderman FW. A survey of the accuracy of chemical analyses in clinical laboratories// Am J Clin Pathol 1947; 17:853-61.
- Witte VanNess S.A., Angstadt D.S., Pennell B.J. Errors, mistakes, blunders, outliers, or unacceptable results: how many? Clin Chem.-1997; 43:1352-6.
- Laposata M., Dighe A. ‘Pre-pre’ and ‘post-post’ analytic error: high incidence patient safety hazards involving the clinical laboratory //Clin Chem Lab Med.-2007; 45:712–9.
- Plebani M., Piva E. Notification of critical values//Biochem Med. -2010; 20:173-178.
- Аминев Р.А. Билалов Ф. С. Ошибки врача при выборе лабораторного исследования на преаналитическом этапе //Российская академия медицинских наук. Бюллетень Национального научно-исследовательского института общественного здоровья. – 2013. – №. 1. – С. 63-66.
- Fauzia Sadiq and all. Frequency of Errors in Clinical Laboratory Practice//Iranian Journal of Pathology.-2014.-№ 9 (1).-Р.45- 49.
- Sushma B.J., Shrikant C. Study on “Pre-analytical Errors in a Clinical Biochemistry Laboratory”: The Hidden Flaws in Total Testing //Biochem Anal Biochem 8:374.-2019. doi: 10.35248/2161-1009.19.8.374.
- Najat D. Prevalence of Pre-Analytical Errors in Clinical Chemistry Diagnostic Labs in Sulaimani City of Iraqi Kurdistan // PLoS One. -2017; 12(1):e0170211.
- Da Rin G. Pre-analytical workstations: A tool for reducing laboratory errors// Clin Chim Acta. — 2009; 404:68-74.
- Simundic A.M., Topic E., Nikolac N., et al. Hemolysis detection and management of hemolyzed specimens // Biochem Med. -2010;20:154-159.
- Bonini P., Plebani M., Ceriotti F., et al. Errors in laboratory medicine// Clin Chem. -2002; 48:691-698.
- Chawla R., Goswami B., Tayal D., et al. Identification of the types of preanalytical errors in the clinical chemistry laboratory: 1-year study at G.B. Pant Hospital //LabMedicine. — 2010; 41:89-92.
- Bates D.W., Gawande A.A. Improving safety with information technology //N Engl J Med. -2003; 348:2526-2534.
- Plebani M., Bonini P. Wrong biochemistry results. Interdepartmental cooperation may help avoid errors in medical laboratories //BMJ. -2002; 324:423-424.
- Lippi G., Guidi G.C. Risk management in the preanalytical phase of laboratory testing //Clin Chem Lab Med. -2007; 45:720-727.
- Lippi G., Chiozza L., Mattiuzzi C., Plebani M. Patient and Sample Identification. Out of the Maze? //Journal of Medical Biochemistry.-2017. -№36 (2).-Р.107-112.
- Makary M.A., Daniel M. Medical error-the third leading cause of death in the us // BMJ.-2016; 353:i2139.
- Bonini P., Plebani M., Ceriotti F., Rubboli F. Errors in laboratory medicine. Clin Chem.-2002; 48:691-8.
- Julie A. Hammerling, A Review of Medical Errors in Laboratory Diagnostics and Where We Are Today//Laboratory Medicine.-2012.-Volume 43.-Issue 2.-P. 41–44.
- Lippi G., Dimundic A.M., Mattiuzzi C. Overview on patient safety in healthcare and laboratory diagnostics //Biochemia Medica. — 2010; 20:131-143.
Лабораторная диагностика. Выявление и предотвращение ошибок
Обзорная
статья М. Плебани (Mario Plebani) «Выявление и предотвращение ошибок в
лабораторной медицине» в Annals of Clinical Biochemistry, № 47, стр. 101-110, 2010 г.
Марио Плебани,
Отделение лабораторной медицины, Больница при университете Падуи, Падуя, Италия
Резюме
За последние несколько десятилетий частота
аналитических ошибок в клинических лабораториях существенно снизилась. Имеются
факты, показывающие, что пре-и постаналитические этапы аналитического процесса
в целом более подвержены ошибкам, чем аналитический этап. Большая часть ошибок
выявлена на пре-преаналитическом и пост-постаналитическом этапах за пределами
лаборатории. Если при оказании медицинских услуг использовать подход,
ориентированный на пациента, необходимо в рамках всего аналитического процесса
исследовать любой возможный дефект, который способен привести к отрицательному
воздействию на пациента. В интересах пациентов необходимо рассмотреть любые
прямые и непрямые негативные последствия, связанные с лабораторными
исследованиями, независимо от того, на каком этапе возникает ошибка и кто
именно отвечает за ее возникновение: специалист лаборатории (например, при
калибровке/выполнении анализа) или другой сотрудник (например, при выборе
теста, идентификации пациента и/или сборе крови). Неверная идентификация
пациентов и проблемы, связанные с передачей результатов, от которых зависит
постановка диагноза, признаны основными направлениями работы по повышению
качества. Международные инициативы направлены на улучшение именно этих аспектов
медицинской помощи. Создание классификации лабораторных ошибок по степени их
серьезности поможет определить приоритеты, которые позволят улучшить качество
анализа, и будет способствовать целенаправленной разработке
корректирующих/превентивных действий. Важно принимать во внимание не только
реально причиненный пациенту вред, но также возможный наихудший исход в случае
повторения ошибки. Наиболее важные уроки, усвоенные нами, заключаются в том,
что системную теорию также можно использовать для лабораторного анализа и что
ошибки и вредоносные последствия можно предотвратить, перестроив систему таким
образом, чтобы всем работникам сферы здравоохранения было трудно совершать
ошибки.
Введение
За последнее десятилетие, после публикации
отчета Института медицины (Institute of Medicine, IOM), носящего название «To
Err Is Human» (Человеку свойственно ошибаться), безопасность пациентов,
наконец-то, стала объектом медицинского и общественного внимания. Осознание и
понимание причин медицинских ошибок получило быстрое распространение, было
развернуто активное движение за безопасность пациентов, выступающее за
повышение безопасности медицинского обслуживания с помощью «системных» решений.
Это стало возможным благодаря основному «посланию», заключенному в отчете IOM:
причина врачебных ошибок и летальных исходов, которые можно было бы избежать,
заключается не в небрежности и некомпетентности людей, а в плохих системах.
Однако, по сравнению с медицинскими ошибками других типов, ошибкам в
лабораторной медицине уделялось мало внимания, и такому упущению есть несколько
причин, приведенных в таблице 1.
Большая часть самых различных терминов,
используемых в литературе для обозначения ошибок в лабораторной медицине
(например, собственно ошибки, промахи, дефекты, выпадающие значения,
неприемлемые результаты и погрешности качества), оставляют негативное чувство
совершенной человеком ошибки и его вины; но, что хуже, используются в тех
работах, в которых рассматривается ограниченное количество этапов
аналитического процесса. Ключевой шаг навстречу инициативам, направленным на
уменьшение ошибок и улучшение безопасности пациентов в данной сфере, будет
сделан по достижении соглашения о том, что считать ошибками в лабораторном
тестировании.
Ошибки в лабораторной медицине по сути своей
трудноопределимы, поскольку их трудно идентифицировать и, даже после
обнаружения, понять их причину сложнее, чем в случае медицинских ошибок другого
типа. Если сравнивать с неблагоприятными исходами, вызванными хирургическим и
другими, зачастую совершенно очевидными, ошибками, совершенными в ходе лечения,
лабораторные ошибки имеют тенденцию быть менее явными, указать время и место их
совершения непросто. Эти трудности в значительной степени объясняются
многоэтапностью процесса анализа. Во-первых, существует определенный промежуток
времени между выполнением лабораторного анализа, действиями врача и результатом
этих действий. Потенциальные ошибки на этапах, непосредственно предшествующих
воздействию на пациента, фактически, с большей вероятностью могут привести к
травме или нанесению вреда пациенту. Ошибки, совершенные на более ранних
этапах, наиболее вероятно приведут к остановке всего процесса, хотя «активные и
пассивные» защитные барьеры – которые зависят от технологий, человеческого
фактора, используемых процедур и административного контроля – могут смягчить их
потенциальный вред или помешать распознать их воздействие на конечный
неблагоприятный исход. Во-вторых, анализ – это комплексная процедура, состоящая
из большого количества этапов и зависящая от многих факторов, обеспечивающих ее
выполнение. Более того, только аналитическая фаза контролируется лабораторией,
а преаналитический и постаналитический этапы относятся к сфере действия других
ответственных сторон, таких как врачи, медсестры, пациенты и прочие лица,
вовлеченные в идентификацию пациента, ввод данных, сбор и транспортировку
образцов.
Таблица 1. Ошибки в лабораторной
медицине: причины недостаточного внимания к проблеме.
|
1. Различные и двусмысленные |
|
2. Сложности выявления и идентификации |
|
3. Комплексность процесса анализа, |
|
4. Недостаточное осознание врачами и |
|
5. Нежелание лабораторных специалистов |
|
6. Увеличение случаев использования |
На постаналитическом этапе возможна неверная
интерпретация и неадекватное использование полученной лабораторной информации.
Поэтому для детальной оценки всего аналитического процесса необходимы хорошо
спланированные исследования, многосторонний подход и коллективная работа.
В-третьих, врачи, отвечающие за клинические решения, редко рассматривают лабораторные
ошибки как причину неблагоприятного воздействия на пациентов, также они не
осознают, что большая часть недочетов в лабораторной работе может быть
следствием ошибок на преаналитическом и постаналитическом этапах. В-четвертых,
лабораторные специалисты, движимые чувством личной ответственности и вины,
неохотно сообщают информацию о частоте появления ошибок и о том, какие именно
ошибки были выявлены в их лаборатории. Это, в свою очередь, затрудняет оценку
всего аналитического процесса и выработку спецификаций качества для каждого
этапа, что позволило бы выявить недочеты в общей организации и используемых
процедурах и обеспечило бы возможность улучшения качества за счет определения и
приоритезации корректирующих действий. И наконец, теперь анализ проводится не
только в клинических лабораториях: прикроватный мониторинг (в настоящее время
наиболее быстро развивающий сегмент рынка медицинских исследований),
непосредственно рядом с пациентом и самим больным в форме самоконтроля – широко
используемые альтернативные или дополнительные формы анализа.
Таким образом, существует острая необходимость в
оценке ошибок лабораторной медицины в рамках надежной рабочей концепции –
аналитического процесса в целом. С точки зрения пациента, значение имеет
надежность процесса в целом и возможность предотвратить любые ошибки на
преаналитическом, аналитическом и постаналитическом этапе. Поэтому любой
возможный дефект аналитического процесса должен быть исследован. Это позволит
предотвратить или устранить любое негативное воздействие на лечебный процесс,
независимо от этапа, на котором произошла ошибка, и лица, совершившего ошибку,
будь то лабораторный специалист (допустивший ошибку, например, при калибровке
или выполнении анализа) или другой сотрудник (допустивший ошибку, к примеру,
при выборе теста, идентификации пациента, сборе крови и/или интерпретации
результатов).
Определение
ошибки
Различие терминов, синонимично используемых в
литературе для обозначения лабораторных ошибок, является следствием различной
структуры исследований, которая в одних случаях позволяет оценить почти
исключительно аналитические ошибки (выбросы, неприемлемые результаты), а в
других, например, при анализе разделенного на порции образца – нечувствительна
ко многим, особенно начальным и/или конечным, этапам аналитического процесса.
Недавно было высказано интересное предложение: использовать какой-нибудь
нейтральный термин, например «недостаточное обеспечение качества» (quality
failure), который позволит смягчить негативное ощущение, связанное с используемыми
ранее терминами, и возникающее при этом чувство вины за совершенную ошибку. По
мысли автора, этот термином обозначается «любая невозможность соответствовать
конечному качеству, необходимому для оказания пациенту оптимальной медицинской
помощи, на любом этапе аналитического процесса, от выбора тестов до передачи
лечащему врачу отчета с правильной интерпретацией результатов». Это определение
имеет четкую направленность на оказание медицинской помощи пациенту и на
результаты этой помощи, а не на процессы и процедуры. Однако термин «ошибка»
(error) используется в медицинской литературе и, следовательно, должен также
применяться для описания ошибок в лабораторной медицине, в частности из-за
того, что они являются частью более широкого спектра диагностических ошибок. В
Технических спецификациях (Technical Specification), выпущенных Международной
организацией по стандартизации (ISO/TS 22367), лабораторная ошибка определяется
следующим образом:
невозможность выполнить запланированное действие
так, как это было запланировано, или использование неверного плана для
достижения цели на любом этапе лабораторного цикла, начиная с составления
заявки на исследование и заканчивая предоставлением отчета о результатах,
правильной интерпретацией результатов и использованием адекватных действий,
соответствующих полученным результатам.
Данное комплексное определение имеет несколько
достоинств и, в частности, содействует ориентированной на пациента оценке
ошибок, возникающих при лабораторном тестировании. Было подчеркнуто, что развитие
медицинской помощи, центрированной на пациенте, должно быть преобразовано в
требование исследовать любой возможный дефект всего аналитического процесса,
который может привести к негативному воздействию на пациента. При ориентации на
пациента следует принимать во внимание любое прямое или косвенное негативное
последствие, связанное с лабораторным тестированием, независимо от того, где
именно расположен источник последствия: на преаналитическом, аналитическом или
постаналитическом этапе; более того, неважно, кто совершил ошибку: специалист,
работающий в лаборатории (например, ошибку калибровки или анализа) или другой
сотрудник (запросивший, к примеру, не тот тест, неверно идентифицировавший
пациента/образец или неправильно проинтерпретировавший результаты). Таким
образом, аналитический процесс в целом является уникальной рабочей концепцией,
которую можно использовать для изучения и идентификации лабораторных ошибок в
различных условиях: в «стандартных» клинических лабораториях, при анализе по
месту лечения (АПМЛ) и при использовании альтернативных способов анализа (у постели
больного и методом самоконтроля).
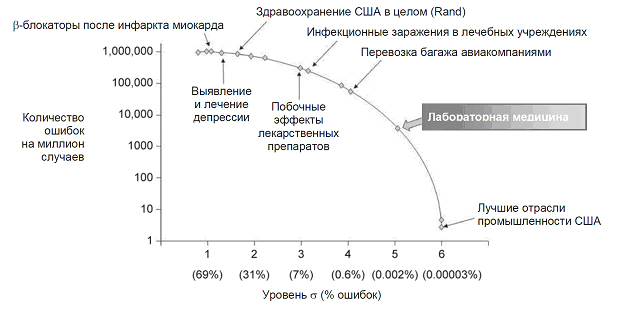
Рис. 1. Частота ошибок в лабораторной
медицине по сравнению с частотой ошибок в других областях деятельности (литературные
данные, с модификациями).
Типы
ошибок в лабораторной медицине и частота их возникновения
Лабораторная медицина, как сфера деятельности, в
которой на первое место ставится контроль качества, всегда была на переднем
фронте борьбы за уменьшение числа ошибок. С точки зрения контроля качества и
уменьшения частоты ошибок, лабораторная медицина имеет гораздо более
впечатляющий послужной список, чем большинство других областей здравоохранения.
В некоторых работах сообщается, что на аналитическом этапе средняя частота
ошибок составляет всего лишь 0.002%; это соответствует работе на уровне пяти
сигма. Для сравнения: частота инфекционных заражений и неблагоприятного
воздействия лекарственных препаратов в результате врачебных ошибок находятся
близко к трем сигма, то есть в этих случаях частота ошибок более чем в 3000 раз
превышает частоту ошибок в клинической лаборатории (рисунок 1). (Концепция
«сигмы», в соответствии со строгим статистическим критерием контроля качества,
заключается в следующем: считается, что процесс находится под контролем, если
вариация показателей процесса – выраженная в виде стандартного отклонения – сигма
– не превышает 1/6 разницы между средними показателями процесса и контрольным
пределом. Процесс, качество которого достигает шести сигма , т.е. процесс с
вариацией показателей 6 сигма, имеет очень мало ошибок: 3,4 ошибки на миллион
случаев).
Однако эти данные выглядят менее впечатляюще,
если рассматривать целиком весь процесс анализа, состоящий из выбора тестов,
составления заявки на исследование, идентификации пациентов, сбора и
транспортировки образцов, выполнения анализа, представления результатов, их
интерпретации и принятия решения на их основе. По словам Марка Грейбера (Mark
Graber), «ошибки, связанные с лабораторным анализом, встречаются очень часто и
составляют значительную часть диагностических ошибок в современной медицине». В
современной клинической медицине лабораторный анализ приобретает особенно
важное значение в диагностическом процессе и при мониторинге эффективности
терапии. Поэтому, даже низкая частота ошибок лабораторного анализа с учетом
миллионов исследований, выполняемых каждый день по всему миру, может оказывать
существенное влияние на здоровье и безопасность пациентов. Данные по частоте
лабораторных ошибок будут самым серьезным образом зависеть от структуры
исследования и, в частности, от исследуемых этапов всего аналитического
процесса. Таким образом, легко понять, почему частота ошибок, согласно
литературным данным, может варьировать: от одной ошибки на 33-50 событий до
одной ошибки на 1000 событий или от одной ошибки на 214 лабораторных
результатов до одной ошибки на 8300 лабораторных результатов.
Аналитические
ошибки
Ранние исследования в области ошибок
лабораторной медицины были посвящены идентификации аналитических ошибок,
поскольку аналитический этап является «сердцем» лабораторной работы и
аналитического процесса, проходящего под контролем лабораторного персонала.
Анализ собранных и представленных литературных данных, начиная с работы Белка и
Сандермана (Belk and Sunderman), опубликованной в 1947 г., продолжая
результатами, собранными Коллегией американских патологов в 90-х и заканчивая
данными, представленными Витте (Witte) с соавторами в 1997 г., показал, что
частота ошибок снизилась с 162116 на миллион лабораторных тестов (part per
million, ppm) до 447 ppm. Это резкое и впечатляющее уменьшение, примерно в 300
раз, произошло благодаря автоматизации, усовершенствованию лабораторных
технологий, стандартизации анализа, использованию тщательно разработанных
правил внутреннего контроля и эффективных схем обеспечения качества, а также
благодаря повышению уровня подготовки персонала. Однако данные, собранные за
последнее время, продемонстрировали, что качество анализа по-прежнему остается
главной проблемой. Вестгард (Westgard) показал, что оценка стандартных
клинических биохимических и коагуляционных тестов по шкале . дает
неудовлетворительные результаты: в лучшем случае от 3 до 4 сигма.
Неудовлетворительное качество анализа было продемонстрировано не только в
области клинической биохимии, но также в области гематологических,
коагуляционных и молекулярно-биологических тестов. В частности, относительно
высокая частота аналитических ошибок и связанных с ними неблагоприятных
клинических последствий была задокументирована при выполнении иммунохимических
исследований. В некоторых случаях аналитическая интерференция в
иммунохимических исследованиях приводит к значительной погрешности результатов.
Недавние данные по интерференции парапротеинов при лабораторном определении
различных аналитов, включая глюкозу, билирубин, С-реактивный белок, креатинин и
альбумин, показали, что частота ошибок данного типа варьирует и, вероятно,
является заниженной. Кроме того, было показано, что гемолиз по-прежнему
вызывает завышение биохимических параметров, что подчеркивает необходимость
более адекватных нормативов для идентификации и подготовки образцов низкого
качества.
Как уже отмечалось ранее, между впечатляющим
уменьшением числа аналитических ошибок за последние десятилетия и тем фактом,
что в настоящее время качество анализа при оценке по шкале сигма нельзя считать
удовлетворительным, нет противоречия. Оценка по шкале шести сигм является одним
из лучших подходов, доступных в данный момент, который обеспечивает получение
объективных количественных показателей и используется в различных отраслях
деятельности. Таким образом, несмотря на впечатляющее улучшение, достигнутое в
качестве анализа, большое количество фактов свидетельствуют о необходимости
дальнейших улучшений. Этого можно добиться, установив и используя в
повседневной практике спецификации качества анализа, основанные на доказанных
фактах; если это будет реализовано, правила внутреннего контроля качества и
процедуры внешней оценки качества станут более адекватными. Более того, имеется
острая необходимость в программах стандартизации, направленных на улучшение
метрологической прослеживаемости и корректирующих отклонения и систематические
ошибки. Наконец, для повышения качества анализа в клинических лабораториях
необходимо ввести более строгую систему количественных показателей, такую как
шкала шести сигм.
Пре-и
постаналитические этапы
Хотя частота лабораторных ошибок сильно
варьирует в зависимости от структуры исследования и рассматриваемых этапов
аналитического процесса, несколько работ, опубликованных между 1989 и 2007 гг.
привлекли внимание лабораторных специалистов к пре-и постаналитическому этапам.
В настоящее время считается, что эти этапы более чувствительны к ошибкам, чем
аналитический этап. Наша группа опубликовала результаты двух работ, в 1997 и
2007 годах, в которых использовалась одна структура исследования, что позволило
нам рассмотреть большую часть этапов всего аналитического процесса в одном и
том же клиническом контексте; в данных работах также использовалось одинаковое
меню срочных лабораторных тестов. Результаты (таблица 2) свидетельствуют о
существенном, хотя и не слишком большом, уменьшении частоты ошибок в 2007 г., при этом
распределение ошибок по этапам оказалось сходным. На преаналитическом этапе
наблюдалась максимальная частота ошибок, чаще всего проблемы возникали из-за
ошибок при заполнении пробирок, вследствие использования неподходящих
контейнеров, а также из-за ошибок при составлении заявок на исследование. В
работе, проведенной в 2007 г.,
была отмечена ошибка идентификации трех пациентов и 14 запланированных для них
тестов (875 ppm). В последней работе наблюдалось значительное снижение доли
неправильно собранных образцов из инфузионного канала. Основными причинами
ошибок на постаналитическом этапе были: в последней работе – слишком большое
общее время анализа, в первой работе – опечатки при вводе с клавиатуры и
отсутствие коррекции ошибочных данных. За счет улучшения процедур обработки
информации, было снижено количество ошибок при вводе заявок на исследование и
идентификации пациентов в больничной палате. Однако и на преаналитическом, и на
постаналитическом этапе появились ошибки нового типа, в частности, ошибки,
связанные с использованием новых информационных систем. Дальнейшие исследования
подтвердили, что пре-и постаналитический этапы гораздо более подвержены
ошибкам, чем аналитический этап.
Пре-пре-и
пост-постаналитические этапы
Несмотря на то, что концепция целостной «петли
интеллекта» (brain-to-brain loop) была разработана Лундбергом еще в 1981 г., лабораторные
специалисты не проявляли сильной обеспокоенности в отношении начальных и
конечных этапов общего аналитического процесса, а именно в отношении выбора
подходящих тестов, правильности идентификации пациентов и образцов,
соответствующей реакции врача на отчет о результатах, правильной интерпретации
и адекватного использования результатов. Однако исследование начальных и
конечных стадий цикла исследования показало, что в настоящее время эти этапы,
выполненные не в клинической лаборатории и не под контролем (по крайней мере,
частичным) лабораторного персонала, более подвержены ошибкам, чем другие.
Недавние данные по ошибкам на пре-преаналитическом этапе – т.е. при выполнении
первоначальных процедур, не в клинической лаборатории и не под контролем (по
крайней мере, частичным) лабораторного персонала – показывают, что ошибки при
выборе необходимых диагностических тестов, включая лабораторные, отвечают за
55% ошибочных и запоздалых диагнозов при амбулаторном наблюдении и 58% ошибок в
отделении неотложной помощи.
Таблица 2. Частота встречаемости и
типы ошибок на различных этапах аналитического процесса (литературные данные).
|
Абсолютная частота (ppm) |
Относительная частота (%) |
|||
|
1996 |
2000 |
1996 |
2000 |
|
|
Общее количество ошибок |
4667 |
3092 |
||
|
Преаналитических |
3186 |
1913 |
62,8 |
61,9 |
|
Аналитических |
617 |
646 |
13,3 |
15,0 |
|
Постаналитических |
864 |
715 |
18,5 |
23,1 |
Было установлено, что на конечных этапах цикла
неправильная интерпретация диагностических и лабораторных тестов отвечает за
большой процент ошибок в амбулаторных условиях, а также в отделениях неотложной
помощи (таблица 3). В одной из недавних работ было установлено, что
неинформирование амбулаторных больных о клинически значимых аномальных
результатах и отсутствие документального подтверждения факта передачи
необходимой информации, является довольно широко распространенным явлением и
происходит один раз на каждые 14 тестов. Примеры включают пациентов,
непроинформированных о высоком уровне общего холестерина (8,2 ммоль/л, 318
мг/дл), низком гематокрите (28,6%) и низком уровне калия (2,6 ммоль/л). Общее
количество случаев, когда пациенту не была передана информация или факт
передачи информации не был задокументирован, составило 7,1%, а диапазон таких
случаев в разных учреждениях от 0% до 26%. Данные сбои при информировании
пациентов о клинически значимых результатах затрудняют переход от традиционной
патерналистской модели взаимодействия врача и пациента к новой модели,
включающей концепцию «совместного принятия решения», в рамках которой врач
предоставляет пациенту и его семье всю клиническую информацию, включая
результаты лабораторных исследований. Другое свидетельство ошибок в действиях
врача в ответ на предоставленные данные лабораторного анализа приводится в
работе, в которой рассматриваются случаи назначения калия, несмотря на наличие
гиперкалиемии. В другом исследовании было установлено, что более 2% (2,6% в 2000 г., 2,1% в 2007 г.) пациентов с уровнем
тиреотропина более 20 мЕ/мл не получили должного наблюдения. И наконец, в
интересном исследовании, проведенном среди стационарных больных, было показано,
что почти у половины из 1095 выписанных пациентов имелись незавершенные
лабораторные и радиологические тесты и результаты 9% этих тестов потенциально
требовали определенных клинических действий. Таким образом, приведенные выше
данные показывают, что начальные и конечные этапы аналитического процесса, в
частности, выбор тестов и действия врачей в ответ на полученные результаты, не
только более подвержены ошибкам, чем все другие этапы, но также более значимы с
точки зрения потенциально неблагоприятного воздействия на пациентов. В таблице
4 приводятся текущие данные об относительной частоте ошибок на различных этапах
аналитического процесса.
Таблица 3. Пост-постаналитические
ошибки: частота неверной интерпретации результатов диагностических тестов в
различных областях медицинской деятельности.
|
Первая помощь |
Лечение внутренних органов |
Неотложная помощь |
|
|
Неверная интерпретация диагностических |
37% |
38% |
37% |
Таблица 4.
Типы
ошибок и их частота на различных этапах всего аналитического процесса (литературные
данные).
|
Этап общего аналитического процесса |
Тип ошибки |
Относительная частота (%) |
|
Пре-преаналитический |
Ошибка при выборе тестов |
46,0-68,2% |
|
Преаналитический |
Неправильная сортировка и пересылка |
3,0-5,3% |
|
Аналитический |
Неисправность оборудования |
7,0-13,0% |
|
Постаналитический |
Ошибочная валидация данных анализа |
12,5-20,0% |
|
Пост-постаналитический |
Запоздалая реакция/Отсутствие реакции |
25,0-45,5% |
Ошибки при
прикроватном мониторинге (РОСТ) и в других альтернативных условиях
Литературных данных об ошибках при РОСТ
недостаточно, основное внимание сосредоточено на аналитических ошибках.
Считается, что преимущество РОСТ, помимо меньшего времени выполнения, заключается
в том, что при РОСТ используется меньше этапов для получения результата. Кроме
того, «существенно уменьшается количество ошибок, возникающих вследствие
транспортировки, постаналитические ошибки практически полностью устраняются,
поскольку результаты предоставляются непосредственно врачу». Это, в свою
очередь, должно привести к уменьшению сопутствующих ошибок. Однако, несмотря на
иллюзию простоты, устройства для РОСТ подвержены влиянию нескольких факторов,
связанных с окружающими условиями и работой оператора. Управление
преаналитическими, аналитическими и постаналитическими процессами – это
основная задача РОСТ, точно так же, как и в централизованных лабораториях.
Недавно мы проанализировали ошибки и проблемы безопасности пациентов, связанные
с РОСТ, использовав модифицированную классификацию ошибок Коста (Kost). В
данной классификации учитываются все этапы процесса анализа. Мы показали, что
РОСТ уменьшает количество ошибок и риск совершения ошибки лишь на нескольких
этапах всего аналитического процесса. Более того, с позиции управления риском,
РОСТ ставит новые серьезные задачи, в частности в отношении компетентности
оператора и точности выполнения процедур. Потенциально более существенная
опасность заключается в том, что быстрая доступность результатов и немедленное
терапевтическое вмешательство могут усилить клиническое воздействие ошибок и
неблагоприятных последствий на пациента. Недавно мы выявили существенное
количество ошибок, возникающих при переписывании данных, полученных с
использованием портативных устройств для определения глюкозы, а также
обнаружили, что часть данных была представлена не полностью, что подчеркивает
уязвимость постаналитической фазы при РОСТ. Хотя эти ошибки совершаются не в
лаборатории (они связаны с использованием результатов медперсоналом), их
следует принимать во внимание в рамках всего аналитического и диагностического
процесса и работать с ними с позиции ориентированного на пациента подхода.
Аналитический процесс в целом, таким образом, обеспечивает уникальную рабочую
концепцию, с помощью которой можно проанализировать ошибки и уменьшить риск их
возникновения не только в «централизованных» лабораториях, но также при
выполнении РОСТ и использовании всех других альтернативных способов анализа.
Последствия
ошибок в лабораторной медицине
Благодаря нескольким барьерам и слоям защиты
между предоставленной лабораторной информацией, процессом принятия решения и
конечным воздействием на пациента, по-видимому, лишь малая доля лабораторных
ошибок действительно приводит к неблагоприятным последствиям и нанесению вреда
пациенту. В таблице 5 представлены литературные данные, касающиеся воздействия
лабораторных ошибок на пациентов.
Вероятность неблагоприятных последствий
лабораторных ошибок и назначения неадекватного лечения варьирует от 2,7% до
12%, но бо.льшая доля лабораторных ошибок (от 24,4% до 30%) отвечает за
возникновение дополнительных проблем, не сказывающихся прямо на здоровье
пациента. В исследованиях, опубликованных нашей группой, ошибки приводили к
неадекватному помещению пациентов в отделение интенсивной терапии, ненужному
переливанию крови, неверному изменению терапии гепарином и дигоксином. Влияние
лабораторных ошибок на дальнейший клинический путь пациента – речь идет о
дополнительных ненужных исследованиях (лабораторных, рентгенографических,
томографических и т.п.), более инвазивных методах анализа, дополнительных
консультациях – гораздо существеннее и, хотя не обязательно причиняет вред,
однако доставляет лишнее беспокойство и ведет к дополнительным расходам, как
для пациента, так и для системы здравоохранения. С точки зрения управления
рисками, подавляющее большинство лабораторных ошибок, имеющих незначительное
прямое влияние на качество предоставляемых медицинских услуг, дают прекрасную
возможность обучения. Фактически, любая ошибка, независимо от ее кажущейся
тривиальности, может указывать на слабые места в общих принципах и в конкретных
лабораторных процедурах. И даже если в данных конкретных обстоятельствах эта
ошибка не имеет вредных последствий, в другой, пусть и незначительно
отличающейся ситуации она может принести вред пациенту.
Таблица 5. Доля ошибок в
лабораторной медицине, оказывающих влияние на пациентов
|
Автор |
Количество ошибок |
Доля ошибок, оказывающих влияние на |
Доля ошибок, имеющих неблагоприятные |
|
Ross, J.W. |
336 |
30 |
7 |
|
Nutting, P.A. |
180 |
27 |
12 |
|
Plebani, M. |
189 |
26 |
6,4 |
|
Carraro, P. |
160 |
24,4 |
2,7 |
Таким образом, система градации лабораторных ошибок
в соответствии с их серьезностью должна помочь идентифицировать приоритетные
направления для работы над улучшением качества медицинской помощи и облегчить
выбор корректирующих/превентивных действий. Система градации позволила бы не
только рассмотреть реальный вред, наносимый пациенту, но также потенциальный,
самый неблагоприятный, исход в случае повторения ошибки. В соответствии с
Техническими спецификациями ISO «Лаборатории медицинские. Уменьшение ошибок
посредством управления рисками и постоянного улучшения» (Medical
laboratories—reduction of
error through risk
management and continual improvement) любая клиническая
лаборатория должна внедрить процедуры, предназначенные для: (a) определения
процессов высокой степени риска, потенциальная ошибка которых может угрожать
безопасности пациентов; (b) для идентификации реальных ситуаций, связанных с
отклонениями от стандартных требований; (c) для оценки сопутствующих угроз
безопасности пациентов; (d) для контроля этих угроз и (e) для мониторинга
эффективности используемого контроля. В дополнение к требованиям ISO/TS 22367
недавно было выдвинуто предложение, обладающее рядом достоинств: для описания
серьезности отдельной лабораторной ошибки использовать пятибалльную систему
актуальных (А) и потенциальных (P) оценок, основанную на конечном клиническом
результате. Более низкая оценка ошибки означает «отсутствие изменений в ведении
пациента; отсутствие неблагоприятных клинических последствий»; а более высокая
– «значительные неблагоприятные клинические последствия». Недавняя работа, в
которой использовалась данная система оценок на протяжении 30-месячного периода
и в которой были рассмотрены 714988 заявок на выполнение лабораторных
исследований, выявила 658 ошибок. 75% ошибок бала присвоена оценка 1 по шкале
«A» (отсутствие неблагоприятных последствий), а 67,9% ошибок была присвоена
оценка 5 по шкале «P» (потенциально значительные неблагоприятные клинические
последствия). Подчеркнем еще раз: эти данные показывают, что лабораторные
ошибки могут играть существенную роль, влияя на общее качество медицинской
помощи, включая безопасность пациентов.
Парадигмы
возникновения ошибок и стратегии, направленные на повышение безопасности
пациентов
Проблема ошибок, совершенных человеком, в
частности ошибок в медицине, может быть рассмотрена тремя способами: в рамках
модели личных ошибок, в рамках модели правовой ответственности и в рамках
системной модели.
Модель
личных ошибок
Давняя и широко распространенная традиция
личного подхода фокусируется на небезопасных действиях, ошибках и процедурных
нарушениях, совершенных людьми, непосредственно задействованными в клиническом
процессе: медсестрами, терапевтами, хирургами, анестезиологами, фармацевтами и,
в редких случаях, сотрудниками лабораторий. В данном подходе причиной
небезопасных действий считаются аберрантные ментальные процессы, такие как
забывчивость, невнимательность, недостаточная мотивация, беспечность,
небрежность и неосторожность. Контрмеры, направленные, главным образом, на
уменьшение нежелательной вариабельности поведения персонала, включают:
дисциплинарные взыскания, угрозу привлечения к суду, потенциальное увольнение,
осуждение и неодобрение. Личный подход, доминирующая традиция в медицине, имеет
серьезные ограничения: он не позволяет подробно проанализировать несчастные
случаи, инциденты, опасные ситуации и рассматривает небезопасные действия вне
их системного контекста, таким образом препятствуя эффективному управлению
рисками.
Модель
правовой ответственности
Согласно этой модели, ответственные
профессиональные работники не должны совершать ошибок, поскольку это является
частью их профессиональных обязанностей. Ошибки случаются редко, но они, тем не
менее, могут привести к неблагоприятному воздействию на пациента. Считается,
что ошибки, имеющие неблагоприятные последствия, совершаются вследствие
халатности и грубой неосторожности, поэтому заслуживают определенных санкций. С
этой позиции доказать связь между первичным действием и плохим конечным
результатом гораздо легче, чем между организационными недостатками и
клиническими решениями. С точки зрения правовой ответственности, удобнее
преследовать индивидуальные ошибки, а не коллективные. Это обстоятельство
усугубляется готовностью профессиональных работников, включая врачей, принять
ответственность за свои действия. Данная модель имеет отрицательные стороны,
включая тот факт, что часто даже самые лучшие специалисты совершают ошибки.
Более того, данная модель препятствует любым попыткам обнародования медицинских
ошибок. Сотрудники опасаются опубликования отчетов, которые могут повредить
репутации лечебного учреждения, привести к потере дохода и вызвать судебное
разбирательство. В то же время эксперты соглашаются, что система добровольного
предоставления информации о медицинских ошибках и неблагоприятных последствиях
имеет огромный потенциал в отношении повышения безопасности медицинского
обслуживания. Более того, модель правовой ответственности способствует развитию
«перестраховочной» медицины, что в рамках лаборатории превращается в проведение
лишних и ненужных исследований и, таким образом, приводит к чрезмерным расходам
и сопутствующей неэффективности.
Системный
подход
Базовое положение системного подхода заключается
в том, что человек свойственно ошибаться и ошибок следует ожидать даже при
самой лучшей организации процесса. Ошибки, рассматриваемые как последствия, а
не причины, берут начало в системных факторах, включая генераторы повторяющихся
ошибок в рабочем пространстве и организационные процессы их вызывающие.
Контрмеры основаны на допущении, что хотя человеческую природу изменить нельзя,
можно улучшить условия, в которых работают люди. В частности, в данном подходе
центральную роль играют средства защиты, барьеры и меры безопасности.
Высокотехнологичные системы, включая клинические лаборатории, имеют много
уровней защиты, но иногда в них появляются дыры, как в кусочках швейцарского
сыра, которые могут на мгновение выстроиться в одну линию, образовав в
многочисленных слоях защиты опасный тоннель, через который вредоносные факторы
способны оказать свое пагубное воздействие. В лабораторной медицине
используются чрезвычайно сложные процедуры. Из факторов, связанных со
сложностью аналитического процесса в целом, вероятно, наиболее значимые факторы
относятся к некоторым этапам и зависят от работников различных специальностей,
задействованных на этих этапах, которые только частично находятся под контролем
лабораторных специалистов. На рисунке 2 показана модель швейцарского сыра,
адаптированная к специфическим условиям лабораторной медицины. В данной модели
рассматриваются наиболее важные проблемы и защитные слои, из которых самыми
эффективными являются идентификация и документирование всех процессов и
процедур, автоматизация и упрощение, адекватное обучение персонала, система
надзора и использование показателей качества. Согласно этой модели, способность
обнаруживать ранние признаки потенциальной ошибки и общее стремление к
внедрению корректирующих мер являются необходимыми условиями создания
эффективной программы управления рисками. Средства управления процессами и
средства анализа потенциальных рисков, такие как FMEA (анализ характера и
последствий отказов), HACCP (анализ рисков и критические точки контроля) и
HAZOP (исследование рисков и работоспособности), уже показали свою
эффективность при идентификации слабых точек лабораторных процессов и
минимизации риска возникновения ошибок.

Рис. 2. Модель швейцарского
сыра, адаптированная к условиям лабораторной медицины: проблемы и защитные
меры. Согласно модели, описанной Reason, наличие бреши в любом защитном слое в
норме не приводит к неблагоприятным последствиям. Обычно это случается только
тогда, когда бреши во многих слоях выстраиваются в одну линию, что создает
канал для потенциально неблагоприятного воздействия.
Процессы,
направленные на уменьшение количества ошибок в лабораторной медицине.
За последние несколько лет, в дополнение к
усилиям, направленным на уменьшение аналитических ошибок и повышение качества
анализа, были достигнуты важные успехи при решении проблемы возникновения
ошибок в лабораторной медицине. Благодаря введению преаналитических рабочих
станций, было достигнуто значительное уменьшение количества преаналитических
ошибок при выполнении автоматизированных процедур, таких как подготовка
образцов, центрифугирование, аликвотирование, пипетирование и сортировка.
Возрастающий интерес к разработке нормативов и стандартных операционных процедур
для идентификации пациентов, для взятия крови, для работы с образцами и для
принятия или отклонения образцов. несомненно, приведет к созданию стандартов
более высокого качества. Также значительные улучшения были введены на
постаналитическом этапе в процедуру записи данных, это стало результатом
внедрения анализаторов, оснащенных протоколами обмена информацией, и
лабораторных информационных систем. Следует подчеркнуть, запись данных является
источником серьезных ошибок, особенно в том случае, когда необходимо вручную
вводить в лабораторный компьютер большое количество чисел и результатов.
Дальнейшие важные улучшения на постаналитическом этапе касаются общих принципов
и процедур, используемых для предоставления отчета о критических значениях, а
также инициатив, направленных на улучшение понимания полученных данных и
повышение эффективности предоставления отчета врачам, запросившим выполнение
исследований. Недавно были разработаны автоматические компьютеризированные
системы передачи информаций, позволившие улучшить своевременность
предоставления данных и избежать потенциальных ошибок за счет контрольного
считывания только что записанного результата. После направления запроса и
подтверждения правильности полученных критических значений лабораторными
специалистами, эти значения автоматически передаются (в режиме реального
времени) врачам, при этом на экране компьютера появляется краткое
информационное или предупреждающее сообщение. Данные информационные системы
(увеличивающие вероятность того, что удастся своевременно связаться с нужным
специалистом), легко адаптировать таким образом, чтобы передавать информацию на
мобильный телефон или настольный компьютер пациента. Это позволит уменьшить
число ошибок или даже полностью устранить ошибки при передаче патологических результатов.
Дальнейшие улучшения касаются введения более эффективных автоматизированных
процедур валидации данных и предоставления отчета, а также внедрения систем
эффективного управления знаниями, предназначенных для интерпретации данных и
принятия клинических решения при прикроватном мониторинге. В самой простой
форма такая система может включать прямые ссылки на лабораторный справочник,
содержащий рекомендации по интерпретации результатов и описание процедур,
необходимых для выполнения конкретных исследований для конкретного пациента.
Аналогичные средства необходимо использовать для того, чтобы уменьшить
количество ошибок при выборе тестов. Точный анализ всех процессов и
задокументированных процедур лабораторного исследования с помощью проактивных
инструментов, таких как FMEA и HAZOP, уже доказал свою эффективность в
уменьшении показателя вероятности риска и, как следствие, в повышении
безопасности пациентов. Данные инструменты упреждающего анализа все чаще и все
более охотно используются лабораторными специалистами и врачами. Данные
инструменты оценивают профессиональную компетенцию через призму позитивного
подхода к существующим проблемам, фокусируясь на исследовании аналитического
процесса в целом, позволяя, таким образом, прогнозировать основные неблагоприятные
последствия и заранее принимать меры для их предотвращения.
Международные
инициативы по снижению количества ошибок в лабораторной медицине
Недавно Всемирный альянс за безопасность
пациентов (World Alliance for Patient Safety) (учрежденный Всемирной ассамблеей
здравоохранения (World Health Assembly) в 2004 г. для улучшения
безопасности пациентов в рамках глобальной инициативы) включил проблему
передачи результатов критически важных тестов в число 23 вопросов, решение
которых потенциально позволит обеспечить безопасность пациентов, признав, таким
образом, важность предотвращения ошибок в лабораторных исследованиях. Вторая
задача, обозначенная в документе «2008 National Patient Safety Goals for
Laboratories» (Обеспечение безопасности пациентов – общенациональные задачи для
лабораторий) Объединенной комиссии (Joint Commission) – это «улучшить
эффективность коммуникации лиц и служб, предоставляющих медицинские услуги»,
первая задача – повысить «точность идентификации пациентов», что подчеркивает
важность начальных и конечных этапов аналитического процесса. Рабочая группа по
лабораторным ошибкам и безопасности пациентов (WG-LEPS) Международной федерации
клинической биохимии и лабораторной медицины (IFCC) разработала проект под
названием «Модель показателей качества» (Model of
quality indicators). Данная модель
основана на идентификации значимых общепринятых показателей качества на всех
этапах аналитического процесса. Вкратце суть дела заключается в следующем:
после обсуждения и анализа предложений, сделанных 26 клиническими
лабораториями, входящими в рабочую группу, были выбраны 25 показателей
качества: 16 для преаналитического, 3 для аналитического и 6 для
постаналитического этапа. В настоящее время, лаборатории, принимающие участие в
данном проекте, могут на специально созданном веб-сайте
(www.3.centroricercabiomedica.it) вводить данные, собранные в их учреждении по
всем показателям качества и по каждому показателю в отдельности. Был сделан
предварительный анализ собранных данных и представлены результаты, однако для
выполнения надежного статистического исследования необходимо собрать
дополнительные данные. В дальнейшем в рамках данного проекта планируется: (a)
определить предварительные спецификации качества для каждого показателя; (b)
оценить данные с использованием предварительных спецификаций качества; (c)
пересмотреть спецификации качества и (d) ввести в действие программу внешней
оценки качества, с помощью которой лаборатории-участники смогут оценивать
качество своей работы, сравнивая полученные результаты с желательными
спецификациями качества для каждого показателя. Глобальная цель данной
программы, таким образом, заключается в том, чтобы побудить клинические
лаборатории оценивать и контролировать качество своей работы не только в ее
аналитическом аспекте, но также на пре-и постаналитических этапах. Кроме того,
благодаря реализации этой программы, появится возможность идентифицировать
ошибки и следить за частотой их появления во всем аналитическом процессе, а
также улучшить этот процесс на основании реальных и желательных спецификаций
качества, установленных научным сообществом.
Еще одно предложение: создать проект,
направленный на идентификацию и использование сигнальных событий в лабораторной
медицине. Сигнальное событие (sentinel event) – это непредвиденный случай,
повлекший смерть или серьезную физическую или психологическую травму, а также
случай, способный привести к таким последствиям. Таким образом, сигнальное
событие сигнализирует о необходимости немедленного расследования и ответных
действий. Термины «сигнальное событие» и «медицинская ошибка» не синонимичны:
не все сигнальные события происходят из-за ошибки и не все ошибки ведут к
сигнальным событиям. Оценка связи клинических последствий с лабораторной
диагностикой является трудной задачей, поэтому возникает еще одна проблема –
идентификация тех лабораторных событий в рамках всего процесса анализа, которые
наиболее тесно связаны с причинением вреда пациенту. Таким образом, на первый
план выдвигается острая потребность в разработке и использовании надежных и
общепринятых показателей качества, которые отражали бы «наилучший способ
осуществления» всего аналитического процесса, а также необходимость
идентификации «лабораторных сигнальных событий», которые способствовали бы
получению дополнительных знаний о непредвиденных случаях. Все это позволило бы
возложить на поставщиков медицинских услуг ответственность за безопасность
пациентов. Имеющиеся в наличии данные указывают, что потенциальные «сигнальные
события» могут включать выбор неподходящих тестов при критических заболеваниях
(например, при инфаркте миокарда, эмболии легочной артерии), неверную
идентификацию пациентов, выполнение неподходящих исследований, серьезные
аналитические ошибки, использование непригодных (гемолизированных, при наличии
сгустка) для выполнения критически важных тестов, предоставление результатов
исследований, несмотря на неудовлетворительные результаты контроля качества,
неинформирование о критических значениях и направление отчета не тому адресату.
И наконец, урок, который мы усвоили, столкнувшись с лабораторной ошибкой,
имевшей самые худшие последствия в Италии (ошибка при записи отчета, которая
привела к заражению ВИЧ трех пациентов, которым произвели пересадку органов):
необходимо избегать переписывания данных от руки. Это трагическое событие,
вызванное человеческой ошибкой, еще раз продемонстрировало наличие слабых мест
в системе и брешей в слоях защиты. В частности, было подчеркнуто, что этот
инцидент произошел вследствие «недостаточного понимания специфики процесса
взятия органов и недооценки последствий для тех пациентов, которым уже
произвели пересадку, и для тех, которые находятся в списках ожидающих, а также
для задействованного персонала» и связанных с этими обстоятельствами процедур.
Принимая во внимание текущие международные инициативы и рекомендации, можно
выделить некоторые приоритетные области, позволяющие повысить безопасность
пациентов и снизить количество ошибок в лабораторной медицине (см. таблицу 6).
Таблица 6. Приоритетные области
лабораторной медицины, позволяющие повысить безопасность пациентов
|
1. Точность идентификации |
|
2. Эффективность передачи лабораторных |
|
3. Передача результатов критически |
|
4. Критерии пригодности и непригодности |
|
5. Правильность выбора тестов; |
|
6. По возможности, исключение |
Заключение
За последние два десятилетия было достигнуто
значительное улучшение в понимании причин возникновения медицинских ошибок и
уменьшении их количества. В конечном итоге, специалисты, занимающиеся этими
вопросами, осознают, что ошибки возникают не из-за «плохих» людей, ошибки – это
показатель недостатков системы, включающей почти все процессы и методы, которые
мы используем для организации и выполнения практически всех действий в медицине,
в том числе, лабораторной медицине. Таким образом, первый урок, который мы
извлекли, заключается в том, что теория системы работает и что ошибки и вредные
последствия можно предотвратить, перестроив систему так, чтобы медицинским
работникам было трудно делать ошибки. В лабораторной медицине анализ процессов,
регистрация/документирование всех процедур и процессов в соответствии со
стандартами качества, в частности ISO 15189: 2007 (стандарт, специально
разработанный для медицинских лабораторий) являются ключевыми инструментами
изменения и улучшения повседневной клинической практики. Тщательный анализ и
контроль всех процедур и процессов, являющихся частью процесса лабораторного
исследования, особенно при использовании эффективных инструментов, таких как
FMEA и HAZOP, могут существенно уменьшить количество слабых сторон и уязвимых
этапов, максимизировав, таким образом, безопасность пациента. Мы убедились, что
аналитический лабораторный процесс, взятый как единое целое – это уникальная
рабочая концепция, позволяющая идентифицировать ошибки и уменьшить их
количество, в том числе на начальных этапах, таких как идентификация пациентов
и выбор тестов, и на конечных этапах, таких как передача и интерпретация
результатов.
Второй урок заключается в том, что коллективная
работа – это квинтэссенция безопасности, особенно, если мы хотим уменьшить
число ошибок при выборе тестов и увеличить количество адекватных реакций на
результаты исследований. Доступность систем поддержки, предоставляющих по месту
лечения информацию о диагностической эффективности и критериях интерпретации,
может играть определенную роль, но кооперация и сотрудничество специалистов
различного профиля является обязательным условием осуществления
ориентированного на пациента подхода к уменьшению количества ошибок.
Международные проекты, направленные на разработку показателей качества для всех
этапов аналитического процесса и установку соответствующих спецификаций
качества, могут дать возможность клиническим лабораториям сравнивать,
контролировать и улучшать качество их повседневной работы, причем не только на
аналитическом этапе. В конечном итоге направления работы, выбранные
международными организациями, такими как Всемирный альянс за безопасность
пациентов (World Alliance for Patient Safety) и Объединенная комиссия (Joint
Commission), должны привести к приоритезации программ повышения качества,
предназначенных для решения общеизвестных критически важных проблем, таких как
идентификация пациентов и передача результатов лабораторных исследований.
Список
литературы
1.
Kohn LT, Corrigan JM, Donaldson MS. To Err is Human: Building A Safer Health
System. Washington, D.C.: National Academies Press, 1999
2. Leape LL. Errors in medicine. Clin Chim Acta 2009;404:2–5
3. Boone DJ. Is it safe to have a laboratory test. Accred Qual Assur
2004;10:5–9
4. O’Kane M. The reporting, classification and grading of quality failures in
the medical laboratories. Clin Chim Acta 2009;404:28–31
5. Plebani M. Errors in clinical laboratories or errors in laboratory medicine?
Clin Chem Lab Med 2006;44:750–9
6. Plebani M. Errors in laboratory medicine and patient safety: the road ahead.
Clin Chem Lab Med 2007;45:700–7
7. Plebani M. Exploring the iceberg of errors in laboratory medicine. Clin Chim
Acta 2009;404:16–23
8. International Organisation for Standardisation/Technical Specification.
Medical laboratories – reduction of error through risk management and continual
improvement. ISO/TS 22367: 2008
9. Hinckley CM. Defining the best quality control systems by design and
inspection. Clin Chem 1997;43:873–9
10. Gras JM, Philippe M. Application of the Six Sigma concept in clinical
laboratories: a review. Clin Chem Lab Med 2007;45:789–96
11. Graber ML. The physician and the laboratory. Partners in reducing
diagnostic error related to laboratory testing. Am J Clin Pathol
2005;124(Suppl. 1):S1–S4
12. McSwiney RR, Woodrow DA. Types of error within a clinical laboratory. J Med
Lab Technol 1969;26:340–6
13. Ross JW, Boone DJ. Institute on Critical Issues in Health Laboratory
Practice. Wilmington, DE: DuPont Press, 1989:173
14. Khoury M, Burnett L, McKay MA. Error rate in Australian chemical pathology
laboratories. Med J Aust 1996;165:128–30
15. Lapworth R, Teal TK. Laboratory blunders revisited. Ann Clin Biochem
1994;31:78–84
16. Bonini P, Plebani M, Ceriotti F, Rubboli F. Errors in laboratory medicine.
Clin Chem 2002;48:691–8
17. Belk WP, Sunderman FW. A survey of the accuracy of chemical analyses in
clinical laboratories. Am J Clin Pathol 1947;17:853–61
18. Steindel SJ, Howanitz PJ, Renner SW. Reasons for proficiency testing
failures in clinical chemistry and blood gas analysis: a College of American
Pathologists Q-Probes study in 665 laboratories.
Arch Pathol Lab Med 1996;120:1094–101
19. Howanitz PJ. Errors in laboratory medicine: practical lessons to improve
patient safety. Arch Pathol Lab Med 2005;129:1252–61
20. Witte VanNess SA, Angstadt DS, Pennell BJ. Errors, mistakes, blunders,
outliers, or unacceptable results: how many? Clin Chem 1997; 43:1352–6
21. Westgard JO, Westgard SA. The quality of laboratory testing today. Am J
Clin Pathol 2006;125:343–54
22. Tate J, Ward G. Interferences in immunoassay. Clin Biochem Rev
2004;25:105–20
23. Ismail AA. Interference from endogenous antibodies in automated
immunoassays: what laboratorians need to know. J Clin Pathol 2009;62:673–8
24. Dalal BI, Bridgen ML. Factidious biochemical measurements resulting from
hematologic conditions. Am J Clin Pathol 2009;131: 195–204
25. Lippi G, Blanckaert N, Bonini P, Green S, Kitchen S, Palicka V, et al.
Haemolysis: an overview of the leading cause of unsuitable specimens in
clinical laboratories. Clin Chem Lab Med 2008;46:764–72
26. Stankovic AK, Romeo P. The role of in vitro diagnostic companies in
reducing laboratory error. Clin Chem Lab Med 2007;45:781–8
27. Plebani M, Carraro P. Mistakes in a stat laboratory: types and frequency.
Clin Chem 1997;43:1348–51
28. Carraro P, Plebani M. Errors in a stat laboratory: types and frequencies 10
years later. Clin Chem 2007;53:1338–42
29. Astion ML, Shojana KG, Hamil TR, Kim S, Ng VL. Classifying laboratory
incidents reports to identify problems that jeopardize patient safety. Am J
Clin Pathol 2003;120:18–26
30. Kalra J. Medical errors: impact on clinical laboratories and other critical
areas. Clin Biochem 2004;37:1052–62
31. Lundberg GD. Acting on significant laboratory results. JAMA 1981;245:1762–3
32. Lundberg GD. The need for an outcome research agenda for clinical
laboratory testing. JAMA 1998;280:565–6
33. Laposata M, Dighe A. ‘Pre–pre’ and ‘post–post’ analytic error: high incidence
patient safety hazards involving the clinical laboratory. Clin Chem Lab Med
2007;45:712–9
34. Stroobants AK, Goldschmidt HM, Plebani M. Error budget
calculations in laboratory medicine: linking the concepts of biological
variation and allowable medical errors. Clin Chim Acta 2003;333:169–76
35. Hickner J, Graham DG, Elder NC, et al. Testing process errors and their
harms and consequences reported from family medicine practices: a study of the American Academy of Family Physicians National
Research Network. Qual Saf Health Care 2008;17:194–200
36. Gandhi TK, Kachalia A, Thomas EJ, et al. Missed and delayed diagnoses in
the ambulatory setting: a study of closed malpractice claims. Ann Intern Med
2006;14&
Факторы, влияющие на результаты анализов
Влияние различных факторов на результаты лабораторных исследований
Лабораторные исследования зачастую служат более чувствительными показателями состояния человека, чем его самочувствие. Результаты анализов отражают физико-химические свойства исследуемой пробы и дают объективную диагностическую информацию в цифровом выражении. Важные решения о стратегии ведения пациента часто основаны на небольших изменениях лабораторных данных. Именно поэтому роль лабораторных тестов, а также спектр и количество проводимых исследований, необходимых в процессе диагностики и лечения заболеваний, постоянно возрастает. Однако из практики работы любой диагностической лаборатории известно, что получаемые ими результаты далеко не всегда являются правильными. Это связано с наличием большого количества непатологических факторов, способных оказывать влияние на конечные результаты лабораторных данных.
Как показывает наш опыт работы, основное количество получаемых неудовлетворительных результатов связано с ошибками, допущенными в ходе проведения анализа. Появление случайных и систематических ошибок на любой стадии анализа будет снижать достоверность лабораторных результатов и, как следствие, затруднит постановку правильного диагноза и проведение адекватного лечения.
ПРЕАНАЛИТИЧЕСКИЙ (ДОЛАБОРАТОРНЫЙ) ЭТАП включает в себя все стадии от назначения анализа клиницистом до поступления пробы в лабораторию на рабочее место, а именно: назначение анализа, взятие биологического материала, его обработку и доставку в лабораторию. Ошибки, возникающие на внелабораторном этапе анализа, составляют от 70% до 95% от общего их числа. Именно они могут оказаться непоправимыми и полностью обесценить весь ход проводимых исследований.
Поэтому правильная организация преаналитического этапа должна стать составной частью любой системы обеспечения качества лабораторного анализа.
При получении, обработке и доставке образцов в лабораторию следует иметь в виду следующие факторы, которые могут быть как устранимыми, так и неустранимыми. Результаты лабораторных исследований подвержены влиянию биологической и аналитической вариации. Если аналитическая вариация зависит от условий выполнения теста, то величина биологической вариации — от целого комплекса факторов. Общая биологическая вариация исследуемых показателей обусловлена внутрииндивидуальной вариацией, наблюдаемой у одного и того же человека в результате влияния биологических ритмов (разное время дня, года), и межиндивидуальной вариацией, вызванной как эндогенными, так и экзогенными факторами.
Факторы биологической вариации (физиологические факторы, факторы среды, условия взятия пробы, токсичные и терапевтические факторы) могут оказать влияние на результаты лабораторных исследований. Часть из них способна вызывать реальные отклонения лабораторных результатов от референтных значений вне связи с патологическим процессом. К таким факторам относят:
- Физиологические закономерности (влияние расы, пола, возраста, типа сложения, характера и объёма привычной активности, питания);
- Влияние окружающей среды (климат, геомагнитные факторы, время года и суток, состав воды и почвы в зоне обитания, социально-бытовая среда);
- Воздействие профессиональных и бытовых токсичных средств (алкоголь, никотин, наркотики) и ятрогенные влияния (диагностические и лечебные процедуры, лекарственные средства);
- Условия взятия пробы (приём пищи, физическая нагрузка, положение тела, стресс во время взятия пробы и др.);
- Методика взятия крови (способ взятия, средства и посуда, консерванты и т.д.);
- Неправильный (по времени) забор материала;
- Условия (температура, встряхивание, влияние света) и время транспортировки биоматериала на исследования в лабораторию.
Рассмотрим влияние наиболее важных факторов на результаты лабораторных анализов.
ПРИЕМ ПИЩИ
Режим питания, состав принимаемой пищи, перерывы в её приёме оказывают существенное влияние на ряд показателей лабораторных исследований. После приема пищи содержание отдельных продуктов обмена в крови может повышаться или подвергаться изменениям в результате постабсорбционных гормональных эффектов. Определение других аналитов может затрудняться вследствие мутности, вызванной хиломикронемией в послеобеденных пробах крови.
После 48 часов голодания может увеличиваться концентрация билирубина в крови. Голодание в течение 72 часов снижает концентрацию глюкозы в крови у здоровых людей до 2,5 ммоль/л, увеличивает концентрацию триглицеридов, свободных жирных кислот без значительных изменений концентрации холестерина. Длительное голодание (2 – 4 недели) также способно влиять на ряд лабораторных показателей. Концентрация общего белка, холестерина, триглицеридов, мочевины, липопротеинов в крови снижается; выведение креатинина и мочевой кислоты почками с мочой повышается. Длительное голодание тесно связано со снижением расхода энергии. Вследствие этого в крови снижается концентрация гормонов щитовидной железы – общего тироксина и еще в большей степени трийодтиронина. Голодание также приводит к увеличению содержания в пробах сыворотки крови кортизола и сульфата дегидроэпиандростерона.
Употребление жирной пищи может повысить концентрацию калия, триглицеридов и щелочной фосфатазы. Активность щелочной фосфатазы в таких случаях может особенно увеличиваться у людей с О- или В-группой крови.
Физиологические изменения после употребления жирной пище в виде гиперхиломикронемии могут увеличивать мутность сыворотки (плазмы) крови и тем самым влиять на результаты измерения оптической плотности. Повышение концентрации липидов в сыворотке крови может быть после употребления пациентом масла, крема или сыра, что приведёт к ложным результатам и потребует повторного анализа.
Определенные виды пищи и режимы питания могут влиять на ряд показателей сыворотки крови и мочи. Потребление большого количества мяса, то есть пищи с высоким содержанием белка, может увеличить концентрации мочевины и аммиака в сыворотке крови, количества уратов (солей кальция) в моче. Пища с высоким отношением ненасыщенных жирных кислот к насыщенным может вызвать снижение концентрации холестерина в сыворотке крови, а мясная пища вызывает увеличение концентрации уратов. Бананы, ананасы, томаты, авокадо богаты серотонином. При их употреблении за 3 дня до исследования мочи на 5-оксииндолуксусную кислоту даже у здорового человека её концентрация может быть повышенной. Напитки, богатые кофеином, увеличивают концентрацию свободных жирных кислот и вызывают выход катехоламинов из надпочечников и мозга (концентрация катехоламинов в сыворотке крови повышается). Кофеин способен повышать активность плазматического ренина. Приём алкоголя увеличивает в крови концентрацию лактата, мочевой кислоты и триглицеридов. Повышенное содержание общего холестерина, мочевой кислоты, гамма-глутамилтранспептидазы и увеличение среднего объема эритроцитов может быть связано с хроническим алкоголизмом.
Бессолевая диета может приводить к повышению уровня альдостерона в 3-5 раз. Концентрация билирубина после 48-часового голодания может повыситься в 2 раза, после еды – снижается на 20–25%; изменения уровня билирубина в течение суток могут достигать 15–30%.
ФИЗИЧЕСКИЕ УПРАЖНЕНИЯ
Состояние физической активности обследуемого оказывает большое влияние на результаты.
Физическая нагрузка может оказывать как преходящее, так и длительное влияние на различные параметры гомеостаза. Преходящие изменения включают в себя вначале снижение, а затем увеличение концентрации свободных жирных кислот в крови, повышение на 180% концентрации аммиака и на 300% — лактата, увеличение активности креатинкиназы, ACT, ЛДГ. Физические упражнения влияют на показатели гемостаза: активируют свертывание крови и функциональную активность тромбоцитов. Изменения указанных показателей связаны с активацией метаболизма и они обычно возвращаются к исходным (до физической нагрузки) значениям вскоре после прекращения физической деятельности. Тем не менее, активность некоторых ферментов (альдолаза, КК, ACT, ЛДГ) может оставаться повышенной в течение 24 ч после 1одночасовой интенсивной физической нагрузки. Длительная физическая нагрузка увеличивает концентрацию в крови половых гормонов, включая тестостерон, андростендион и лютеинизирующий гормон (ЛГ).
При длительном строгом постельном режиме и ограничении физической активности повышается экскреция с мочой норадреналина, кальция, хлора, фосфатов, аммиака, активность щелочной фосфатазы в сыворотке крови.
ЭМОЦИОНАЛЬНЫЙ СТРЕСС
Влияние психического стресса (страх перед взятием крови, перед операцией и т.д.) на результаты лабораторных тестов часто недооценивается. Между тем под его влиянием возможны преходящий лейкоцитоз; снижение концентрации железа; увеличение уровня катехоламинов, альдостерона, кортизола, пролактина, ангиотензина, ренина, соматотропного гормона, ТТГ и повышение концентрации альбумина, глюкозы, фибриногена, инсулина и холестерина. Сильное беспокойство, сопровождаемое гипервентиляцией, вызывает дисбаланс кислотно-основного состояния (КОС) с увеличением концентрации лактата и жирных кислот в крови.
ПОЛ ПАЦИЕНТА
Для целого ряда клинико-химических и гематологических показателей имеются статистически значимые различия между полами. В частности, это относится к уровням стероидных и гликопротеидных гормонов (прогестерон, эстрадиол, тестостерон, 17-ОН прогестерон, ЛГ, ФСГ, пролактин), транспортных белков (ССГ, ТСГ) и других биологически активных соединений (ТГ). В методической литературе имеется обширная информация по этому вопросу, кроме того, ее можно найти в большинстве инструкций по использованию диагностических наборов. Однако следует отметить, что приведенные в литературе референсные интервалы следует рассматривать лишь как ориентировочные. Это связано с наличием конструктивных особенностей наборов от различных фирм-производителей, а также с региональными и расовыми различиями в составе населения. Поэтому в каждой лаборатории рекомендуется установить собственные значения нормальных уровней исследуемых показателей с использованием тех видов наборов, которые регулярно применяются в рутинной практике.
ВОЗРАСТ ПАЦИЕНТА
Концентрация целого спектра аналитов зависит от возраста пациента и может значительно изменяться от момента рождения до старости. Наиболее ярко возрастные изменения выражены для некоторых биохимических показателей (гемоглобин, билирубин, активность щелочной фосфатазы, содержание липопротеинов низкой плотности и др.) а также для ряда аналитов, определяемых иммунохимическими методами. К ним относятся половые стероидные и гликопротеидные гормоны, тиреоиды, АКТГ, альдостерон, ренин, гормон роста (соматотропный), паратгормон, 17-оксипрогестерон, дегидроэпиандростерон, ПСА и др. Желательно, чтобы в каждой лаборатории имелись возрастные нормы для каждого из исследуемых показателей, что позволит более точно интерпретировать полученные результаты.
БЕРЕМЕННОСТЬ
Трактуя результаты лабораторных исследований у беременных, необходимо учитывать срок беременности в момент взятия пробы. При физиологической беременности средний объем плазмы возрастает примерно от 2600 до 3900 мл, причем в первые 10 недель прирост может быть незначительным, а затем происходит нарастающее увеличение объема к 35-й неделе, когда достигается указанный уровень. Объем мочи также может физиологически увеличиваться до 25% в 3-м триместре. В последнем триместре наблюдается 50% физиологическое повышение скорости клубочковой фильтрации.
Беременность является нормальным физиологическим процессом, который сопровождаются значительными изменениями в выработке стероидных, гликопротеидных и тиреоидных гормонов, транспортных белков (ССГ, ТСГ), АКТГ, ренина, а также в целом ряде биохимических и гематологических показателей. Поэтому для правильной интерпретации результатов важно точно указать срок беременности, когда была взята исследуемая проба крови.
При проведении скрининга врожденных пороков развития плода по лабораторным показателям следует иметь в виду, что диагностическая чувствительность и специфичность данного вида исследования в значительной степени будет определяться комбинацией выбранных иммунохимических маркеров. Она должна быть различной на разных стадиях развития плода. Например, для первого триместра беременности наиболее предпочтительным является определение АФП, свободной 6-субъединицы ХГЧ и ассоциированного с беременностью белка А (РАРРА), а для второго триместра — АФП, общего ХГЧ и свободного эстриола. Все указанные виды анализа должны проводиться в строго рекомендуемые сроки беременности, а каждая лаборатория, занимающаяся скрининговыми исследованиями, должна располагать собственной постоянно обновляемой и пополняемой базой медиан уровней исследуемых маркеров для каждой недели беременности.
МЕНСТРУАЛЬНЫЙ ЦИКЛ
Статистически значимые изменения концентрации могут быть вызваны колебаниями гормонального фона при менструации. Так, концентрация альдостерона в плазме определяется в два раза выше перед овуляцией, чем в фолликулярной фазе. Подобным образом ренин может проявить предовуляторное повышение.
Менструальный цикл является нормальным физиологическим процессом, который сопровождается значительными изменениями в выработке половых, тиреоидных гормонов, транспортных белков, АКТГ, ренина, а также в целом ряде биохимических и гематологических показателей. Для правильной интерпретации результатов важно точно указать день менструального цикла, когда была взята исследуемая проба крови.
БИОЛОГИЧЕСКИЕ РИТМЫ
Существуют линейные хронобиологические ритмы — например, возраст пациента, циклические ритмы — такие, как циркадные и сезонные, а также другие биологические циклы — например, менструальный цикл.
Циркадные ритмы аналита, т.е. изменения его концентрации в течение суток, наиболее ярко выражены у кортизола, АКТГ, альдостерона, пролактина, ренина, ТТГ, паратгормона, тестостерона и др. Отклонения концентраций от среднесуточных значений могут достигать 50%-400%, и этот фактор обязательно должен приниматься во внимание.
Суточные колебания содержания некоторых аналитов в сыворотке крови
|
Аналиты |
Максимальная концентрация (время суток) |
Минимальная концентрация (время суток) |
Амплитуда (% от средней за сутки) |
|
АКТГ |
6-10 |
0-4 |
150-200 |
|
Кортизол |
5-8 |
21-3 |
180-200 |
|
Тестостерон |
2-4 |
20-24 |
30-50 |
|
ТСГ |
20-2 |
7-13 |
5-15 |
|
Та |
8-12 |
23-3 |
10-20 |
|
ТТГ |
21-23 |
1-21 |
300-400 |
|
Пролактин |
5-7 |
10-12 |
80-100 |
|
Альдостерон |
2-4 |
12-14 |
60-80 |
|
Ренин |
0-6 |
10-12 |
120-140 |
|
Адреналин |
9-12 |
2-5 |
30-50 |
Например, циркадный ритм кортизола может являться причиной недостоверных результатов теста на толерантность к глюкозе, если он проводится во второй половине дня.
Для того чтобы не затруднять процесс интерпретации результатов, отбор проб для анализа нужно проводить строго в определенное время суток, обычно между 7:00 и 9:00 часами утра. Следует иметь в виду, что референсные интервалы большинства тестов, приведенных в справочной литературе, установлены именно для этого промежутка времени.
При проведении специальных исследований, например, при установлении индивидуального циркадного ритма секреции гормона, в течение суток берется несколько проб анализируемого материала. В документах, сопровождающих такие образцы, необходимо указать точное время взятия каждого из них.
На циркадный ритм могут накладываться индивидуальные ритмы сна, еды, физической активности, которые не следует путать с действительно суточными колебаниями. Для того, чтобы исключить индивидуальные ритмы при определении уровня аналитов, секретируемых порциями (ренин, вазопрессин, тестостерон, пролактин и др.), можно использовать смешанную пробу, полученную из трех образцов крови, взятых с интервалом в 2-3 часа. В некоторых случаях следует учитывать сезонные влияния. Например, содержание трийодтиронина на 20% ниже летом, чем зимой.
ПРИЕМ ЛЕКАРСТВЕННЫХ ПРЕПАРАТОВ
Прием может отражаться на количественном содержании в организме целого ряда анализируемых показателей. Например, уровень ТТГ снижается при лечении допамином, концентрация общих и свободных фракций тиреоидных гормонов будет изменяться при введении фуросемида, даназола, амиодарона и салицилатов, а применение некоторых противоязвенных препаратов может повышать уровень пролактина у мужчин.
Присутствие лекарственных препаратов в биологическом материале – например, контрацептивов, салицилатов, андрогенов и др. — может специфическим (перекрестная реакция) или неспецифическим образом (интерференция) влиять на результаты лабораторных исследований при определении концентрации стероидных и тиреоидных гормонов, а также специфических связывающих белков крови. Прием аспиринсодержащих препаратов при определении длительности кровотечения по Дуке должен быть отменен за 7 – 10 дней до исследования. Если этого не сделать, можно получить патологический результат исследования. Поэтому проведение медикаментозной терапии, могущей искажать результаты анализа, следует назначать после взятия проб крови.
При проведении лекарственного мониторинга точное время взятия крови является очень важным параметром для правильной интерпретации результатов исследования.
Широкий спектр лекарственной интерференции в ходе лабораторных исследований рассмотрен во многих обзорах и книгах. Чтобы исключить возможность получения ложных результатов, обусловленных применением лекарственных препаратов, рекомендуется консультироваться с клиницистами, а также использовать соответствующие справочники.
При подготовке обследуемых к проведению биохимических исследований приняты следующие подходы: лекарства, мешающие определению компонентов, исключаются до взятия биоматериала, если они даются не по жизненным показаниям; утренний прием лекарств проводится только после взятия биоматериала; взятие крови с диагностической целью проводится перед инфузией лекарств и растворов. Загрязнение лабораторных проб инфузионными растворами является самой обычной и часто встречаемой формой преаналитической интерференции в больницах. Рекомендуется информировать лабораторию о том, когда и какое вливание было проведено пациенту, и когда была взята проба крови.
Пробу крови никогда не следует брать из сосуда, расположенного проксимально месту инфузии. Пробы следует брать из другой руки, из вены, в которую не проводится вливание.
Влияние ЛС на результаты лабораторных исследований может быть двух типов:
- Физиологическое влияние in vivo (в организме пациента) ЛС и их метаболитов;
- Влияние in vitro (на химическую реакцию, используемую для определения показатели) благодаря химическим и физическим свойствам ЛС (интерференция).
Физиологическое влияние ЛС и их метаболитов во многом известны практическим врачам. Рассмотрим значение интерференции, то есть вмешательства постороннего фактора в результаты анализа.
Интерференция может быть вызвана наличием в пробе биоматериала как эндогенного, так и экзогенного вещества. К основным эндогенным интерферирующим факторам относят следующие:
- Гемолиз, т.е. разрушение эритроцитов с выходом в жидкую часть крови ряда внутриклеточных компонентов (гемоглобин, ЛДГ, калия, магния и др.), что изменяет истинные результаты определения концентрации/активности таких компонентов крови, как билирубин, липаза, КК,ЛДГ, калий, магний и др;
- Липемия, извращающая результаты ряда колориметрических и нефелометрических методов исследования (особенно при исследовании фосфора, общего билирубина, мочевой кислоты, общего белка, электролитов);
- Парапротеинемия, вызывающая изменения результатов определения некоторыми методами фосфатов, мочевины, КК, ЛДГ, амилазы.
Наиболее частые экзогенные интерферирующие факторы — ЛС или их метаболиты. Так, при определении катехоламинов флуориметрическим методом в моче интенсивную флюоресценцию может вызывать принимаемый пациентом тетрациклин; метаболит пропранолола 4-гидррксипропранолол интерферирует при определении билирубина методами Йендрассика-Грофа и Эвелина-Меллоя.
Выявить интерференцию ЛС — одна из задач врача клинической лабораторной диагностики. Важный шаг для решения этой проблемы — контакт с клиницистом для выяснения характера принимаемых пациентом препаратов.
КУРЕНИЕ
У курильщиков может быть повышена концентрация карбоксигемоглобина, катехоламинов в плазме крови и кортизола в сыворотке крови. Изменения концентрации этих гормонов часто приводят к снижению количества эозинофилов, в то время как содержание нейтрофилов, моноцитов и свободных жирных кислот увеличивается. Курение приводит к увеличению концентрации гемоглобина, количества эритроцитов, среднего объёма эритроцита (MCV) и снижению количества лейкоцитов. Обнаружено повышение активности гаммаглутамилтрансферазы на 10% при потреблении 1 пачки сигарет в день; возможно удвоение активности по сравнению с референтными значениями при потреблении большего количества сигарет.
ДИАГНОСТИЧЕСКИЕ И ЛЕЧЕБНЫЕ МЕРОПРИЯТИЯ
На результаты лабораторных исследований могут оказывать влияние следующие диагностические и лечебные мероприятия:
- Оперативные вмешательства;
- Вливания и переливания;
- Пункции, инъекции, биопсии, пальпация, общий массаж;
- Эндоскопия;
- Диализ;
- Физическое напряжение (например, эргометрия, физические упражнения, ЭКГ);
- Функциональные тесты (например, пероральный тест на толерантность к глюкозе);
- Прием рентгеноконтрастных и лекарственных веществ;
- Ионизирующее излучение.
Например, уровень ПСА в течение нескольких дней может быть повышен после массажа простаты или катетеризации мочевого пузыря. Любые манипуляции с молочной железой или тепловые процедуры (например, сауна) приводят к значительному возрастанию уровня пролактина. Чтобы предотвратить такое влияние, взятие проб необходимо проводить до выполнения диагностических процедур, способных искажать результаты теста. Влагалищное кровотечение, произошедшее перед взятием пробы крови, может влиять на результат скрининга: кровотечение может увеличивать уровень АФП в крови матери. В этих условиях рекомендуется отложить анализ ~ на одну неделю после остановки кровотечения.
ПЕРИОДИЧНОСТЬ ВЗЯТИЯ ПРОБ
Повторные взятия проб крови широко используются в динамических исследованиях — при проведении стимуляционных тестов, для оценки эффективности проводимого лечения, при прогнозировании исхода заболевания, при лекарственном мониторинге, а также в целом ряде других случаев. Интервалы между взятием образцов, помимо конкретных задач исследования, должны определяться с учетом следующих факторов:
- Периода биологической полужизни определяемого аналита. Например, для оценки уровня ПСА в постоперационном периоде отбор крови для исследования должен проводиться не ранее, чем через 10-14 дней после хирургического вмешательства;
- Факмакокинетических свойств препаратов при проведении терапевтического лекарственного мониторинга. Например, забор крови для определения циклоспорина А должен производиться непосредственно перед приемом следующей его дозы, а для сердечных гликозидов — через 4 часа после введения препарата.
- Динамики изменения концентрации аналита в ходе нормальных или патологических процессов (мониторинг беременности, диагностика и мониторинг опухолевых и инфекционных заболеваний и др.). Обычно при этом индивидуальные колебания уровней исследуемых аналитов могут быть очень значительными (свободный эстриол, ХГЧ, АФП и др.). В этих случаях средние значения нормы или ее диапазоны не являются достаточно информативными для постановки диагноза. Вместо них используют значения медиан нормальных концентраций.
При мониторинге опухолевых заболеваний, а также для оценки эффективности проводимого лечения в качестве точки отсчета используются индивидуальные базовые уровни онкомаркеров до начала терапии. Последующие заборы крови проводятся через строго определенные клиницистами промежутки времени. Этот же принцип используется при диагностике и лечении инфекционных заболеваний — выявление специфических антител к возбудителю и динамика их уровней в ходе лечения.
При хранении образцов мочи при комнатной температуре может теряться до 40% глюкозы после 24-часового хранения.
ПОЛОЖЕНИЕ ТЕЛА ПАЦИЕНТА ПРИ ЗАБОРЕ КРОВИ
Положение тела пациента также влияет на ряд показателей. Переход из положения лёжа в положение сидя или стоя приводит к гидростатическому проникновению воды и фильтрующихся веществ из внутрисосудистого пространства в интерстициальное. Вещества, имеющие большую молекулярную массу (белки), и клетки крови со связанными с ними веществами не проходят в ткани, поэтому их концентрация в крови повышается (ферменты, общий белок, альбумин, железо, билирубин, ХС, ТГ, ЛС; связанные с белками, кальций). Могут увеличиваться концентрация гемоглобина, гематокрит, количество лейкоцитов. Отбор крови для определения ряда аналитов — таких, как альдостерон, эпинефрин, норэпинефрин, предсердный натрийуретический пептид, а также для оценки активности плазматического ренина — следует проводить в положении лежа и/или стоя при спокойном состоянии пациента. В направлении должна быть сделана специальная отметка о времени и условиях получения пробы.
МЕСТО И ТЕХНИКА ЗАБОРА КРОВИ
Место и техника забора крови также могут оказать существенное влияние на результаты лабораторных тестов (например, наложение жгута на период времени более 2 мин при заборе крови из вены может привести к гемоконцентрации и увеличению концентрации в крови белков, факторов коагуляции, содержания клеточных элементов). Лучшее место забора крови на анализы — локтевая вена. Следует также отметить, что венозная кровь — лучший материал не только для определения биохимических, гормональных, серологических, иммунологических показателей, но и для общеклинического исследования. Это обусловлено тем, что применяемые в настоящее время гематологические анализаторы, с помощью которых проводят общеклинические исследования крови (подсчёт клеток, определение гемоглобина, гематокрита и др.), предназначены для работы с венозной кровью, и в большинстве своём в странах, где их производят, они сертифицированы и стандартизированы для работы только с венозной кровью. Выпускаемые фирмами калибровочные и контрольные материалы также предназначены для калибровки гематологических анализаторов по венозной крови.
Помимо этого, при заборе крови из пальца возможен ряд методических особенностей, которые стандартизировать очень трудно (холодные, цианотичные, отёчные пальцы, необходимость в разведении исследуемой крови и др.), что приводит к значительным разбросам в получаемых результатах и как следствие — к необходимости повторных исследований для уточнения результата.
Для общеклинического исследования кровь из пальца рекомендуют забирать в следующих случаях:
- При ожогах, занимающих большую площадь поверхности тела пациента;
- При наличии у пациента очень мелких вен или их малой доступности;
- При выраженном ожирении пациента;
- При установленной склонности к венозному тромбозу;
- У новорождённых.
Пункцию артерии для забора крови используют редко (преимущественно для исследования газового состава артериальной крови).
ДРУГИЕ ФАКТОРЫ
Среди других факторов, влияющих на результаты исследований, имеют значение расовая принадлежность, географическое положение местности, высота над уровнем моря, температура окружающей среды.
Например; уровни АФП выше у женщин негроидной расы по сравнению с европеоидной расой. Активность ГГТ приблизительно в два раза выше у афро-американцев по сравнению с белым населением.
Как правильно подготовиться к исследованиям в клинико-диагностической лаборатории
АНАЛИЗ КРОВИ (КЛИНИЧЕСКИЙ, БИОХИМИЧЕСКИЙ, ИММУНОФЕРМЕНТНЫЙ)
- Исследование производится утром натощак – между последним приемом пищи и взятием крови должно пройти не менее 8 – 12 часов. Вечером предшествующего дня рекомендуется необильный ужин. Желательно за 1 – 2 дня до обследования исключить из рациона жирное, жареное и алкоголь. Если накануне состоялось застолье или было посещение бани или сауны – необходимо перенести лабораторное исследование на 1 – 2 дня;
- Накануне исследования лечь спать в обычное время и встать не позднее чем за 1 час до взятия крови;
- По возможности пробы следует брать между 7 и 9 часами утра;
- Период воздержания от приема алкоголя должен быть не менее 24 ч до сдачи анализа;
- За 1 час до взятия крови необходимо воздержаться от курения;
- Не следует сдавать кровь после рентгенологических исследований, физиотерапевтических и лечебных процедур, способных оказать влияние на результаты теста;
- Необходимо исключить факторы, влияющие на результаты исследований: физическое напряжение (бег, подъем по лестнице), эмоциональное возбуждение. Перед процедурой следует отдохнуть 10 – 15 минут и успокоиться. Для исключения влияния изменения положения тела обследуемый должен находиться в покое, сидеть или лежать не менее 5 мин. При динамическом наблюдении за пациентом взятие материала нужно проводить в идентичном положении тела;
- Необходимо помнить, что результат исследования может быть искажен действием принимаемых лекарственных препаратов. Поэтому перед сдачей анализа следует проконсультироваться у врача о возможности ограничения приема лекарственных препаратов для подготовки к исследованию. Рекомендуется отказаться от приема лекарственных препаратов перед сдачей крови на исследование, то есть забор крови производится до приема лекарственных препаратов;
- Учитывая суточные ритмы изменения показателей крови повторные исследования целесообразно проводить в одно и то же время;
- В разных лабораториях могут применяться разные методы исследования и единицы измерения. Чтобы оценка результатов обследования была корректной и была приемлемость результатов, желательно проводить исследования в одной и той же лаборатории, в одно и то же время.
ТЕСТ ТОЛЕРАНТНОСТИ К ГЛЮКОЗЕ (САХАРНАЯ КРИВАЯ)
Пероральный тест толерантности к глюкозе проводится, если клинические симптомы сахарного диабета отсутствуют, а содержание глюкозы в крови натощак ниже патологического уровня и находится в пределах физиологической нормы (предварительно необходимо провести исследование глюкозы в крови натощак).
Цель теста – определить эффективность работы инсулиновыделительного механизма поджелудочной железы и глюкозораспределительной системы организма. Необходимо подготовиться к этому тесту изменением диеты и приема лекарственных препаратов, по меньшей мере, за 3 дня до проведения теста. Очень важно точно следовать приведенной ниже инструкции, так как только в этом случае будут получены ценные результаты теста:
- Количество углеводов в пище должно быть не менее 125 граммов в день в течение 3 дней перед проведением теста;
- Нельзя ничего есть в течение 12 часов, предшествующих началу теста, но ни в коем случае голодание не должно быть более 16 часов;
- Не позволять себе физические нагрузки в течение 12 часов перед началом теста и во время проведения теста.
Методика проведения теста. Исследование производится дважды с интервалом в 2 часа. Утром, натощак, производится забор крови на глюкозу. Затем пациенту дают определенное количество глюкозы (в зависимости от массы тела), растворенной в теплой воде. Нагрузку следует принять медленно, не залпом, но не дольше, чем за 5 минут. За это время формируется адекватная физиологическая реакция на прием большого количества углеводов. После приема нагрузки производят повторный забор крови на глюкозу через 2 часа. Вместо глюкозы можно использовать пробный завтрак, содержащий не менее 120 граммов углеводов, 30 грамм из которых должны составлять легкоусвояемые (сахар, варенье, джем).
ОСОБЕННОСТИ ПОДГОТОВКИ К ОТДЕЛЬНЫМ ЛАБОРАТОРНЫМ ТЕСТАМ
Исследование холестерина и липидного спектра
Для определения холестерина и липидного спектра забор крови производится строго после 12 – 14 часового голодания. За 2 недели необходимо отменить препараты, понижающие уровень липидов в крови, если не ставиться цель определить гиполипидемический эффект терапии этими препаратами. Накануне взятия крови должен быть исключен прием алкоголя: присутствие алкоголя в крои является распространенной причиной выявления гипертриглицеридемии, даже у голодавших пациентов. Если исследование липидов проводится у больного, перенесшего инфаркт миокарда, то кровь следует брать либо в течение 24 часов после инфаркта, либо по истечении 3 месяцев, поскольку в период выздоровления метаболизм липидов нарушен.
Мочевая кислота
Необходимо в предшествующие исследованию дни соблюдать диету – отказаться от употребления богатой пуринами пищи: печени, почек, максимально ограничить в рационе мясо, рыбу, кофе, чай, алкоголь. Противопоказаны интенсивные физические нагрузки. Обязательна отмена таких лекарственных препаратов, как кофеин, теобромин, теофилин, салицилаты, аскорбиновая кислота, антибиотики, сульфаниламиды, производные тиазола.
Билирубин
Не рекомендуется накануне принимать аскорбиновую кислоту, лекарства или продукты, вызывающие искусственную окраску сыворотки.
Кортизол
Накануне исследования исключить прием таких препаратов как: глюкокортикоиды, эстрогены, пероральные контрацептивы. Также необходимо исключить прием алкоголя, физические упражнения, курение, стрессовые ситуации. Забор крови осуществляется не позднее 2-х часов после сна и до 10 часов утра.
Простатспецифический антиген (ПСА)
Забор крови должен быть произведен до пальпаторного исследования и массажа предстательной железы (ПЖ), лазерной терапии, рентгенографии, цистоскопии, колоноскопии. Эти лечебно – диагностические мероприятия могут вызвать более или менее выраженный и длительный подъем уровня ПСА в крови. Так как степень таких изменений непредсказуема, забор крови необходимо проводить или до или спустя неделю после проведенных манипуляций.
Диагностики инфекционных заболеваний (в том числе урогенитальные инфекции)
Забор крови для диагностики производится до начала приема антибактериальных и химиотерапевтических препаратов или не ранее чем через 10 – 14 дней после их отмены. При выполнении исследований на наличие инфекций следует учитывать, что в зависимости от периода инфицирования и состояния иммунной системы у любого пациента может быть ложноотрицательный результат. Но, тем не менее, отрицательный результат не исключает полностью наличие инфекции и в сомнительных случаях необходимо провести повторный анализ.
Иммунограмма
Анализ крови сдается строго натощак, после 12-часового голодания и обязательно до начала приема антибактериальных, противовоспалительных и гормональных препаратов или не ранее чем через 2 недели после их отмены. Если накануне исследования было повышение температуры, какое либо острое или обострение хронического заболевания, то лучше перенести срок сдачи анализа.
Аллергены
Для исключения ложноотрицательных результатов необходимо воздержаться от приема противоаллергенных препаратов за 3 – 5 дней до сдачи анализа крови.
Пролактин
Забор крови производится утром, не ранее, чем через 3 часа после пробуждения. Учитывая, что уровень пролактина может повышаться в результате физического или эмоционального стресса, после половых актов, после пребывания в сауне, приема алкоголя, необходимо перед исследованием исключить указанные факторы.
Исследование на тиреоидные гормоны
За 2 – 3 дня до проведения исследования исключается прием йодсодержащих препаратов, за 1 месяц – тиреоидных гормонов (чтобы получить истинные базальные уровни), если нет специальных указаний врача- эндокринолога. Однако, если целью исследования является контроль за дозой препаратов тиреоидных гормонов, забор крови производится на фоне приема обычной дозы.
Тиреоглобулин
Исследование целесообразно проводить спустя как минимум 6 недель после тиреоэктомии, либо проведенного лечения. Если назначены такие диагностические процедуры, как биопсия или сканирование ЩЖ, то исследование уровня ТГ в крови нужно строго проводить до процедур.
Соматотропный гормон
За 3 дня до взятия крови необходимо исключить спортивные тренировки, стрессовые ситуации. За 1 час до взятия крови — курение. Исследование проводится натощак (через 12 часов после последнего приема пищи). Пациент должен находиться в полном покое в течение 30 минут перед взятием крови. Не допускать стресса в процессе взятия крови.
ОБЩИЙ АНАЛИЗ МОЧИ
Для общего анализа мочи предпочтительно использовать «утреннюю» мочу, которая в течение ночи собирается в мочевом пузыре. Моча должна быть собрана после тщательного туалета наружных половых органов (несоблюдение этого правила может повлечь за собой выявление повышенного количества эритроцитов и лейкоцитов в моче, что затруднит постановку правильного диагноза) в сухую, чистую, хорошо отмытую от чистящих и дезинфицирующих средств посуду (для сбора мочи лучше использовать одноразовые пластиковые контейнеры). Для анализа можно собирать всю мочу, однако, в нее могут попасть элементы воспаления мочеиспускательного канала, наружных половых органов. Поэтому, как правило, первую порцию мочи не используют. Вторую, среднюю, порцию мочи собирают в чистую посуду, не касаясь склянкой тела. Посуда с мочой плотно закрывается крышкой. Моча, собранная для общего анализа, может храниться не более 1,5 – 2 часов (обязательно на холоду!). Длительное хранение мочи при комнатной температуре приводит к изменению физических свойств, разрушению клеток и размножению бактерий.
Накануне сдачи анализа следует исключить алкоголь, маринады, копчености, сахар, мед.
СБОР СУТОЧНОЙ МОЧИ ДЛЯ БИОХИМИЧЕСКОГО АНАЛИЗА
Суточная моча собирается в течение 24 часов на обычном питьевом режиме. Утром в 6 – 8 часов освобождается мочевой пузырь (эта порция мочи выливается), а затем в течение суток собирается вся моча в чистый широкогорлый сосуд с плотно закрывающейся крышкой, емкостью не менее 2 литров. При этом емкость с мочой необходимо сохранять в течение всего времени в прохладном месте (оптимально – в холодильнике на нижней полке – при 4 – 8 С), не допуская ее замерзания. Последняя порция берется точно в то же время, когда накануне был начат сбор (время начала и конца сбора отмечают). Если не вся моча доставляется в лабораторию, то количество суточной мочи измеряется мерным цилиндром, часть отливается в чистый сосуд, в котором ее доставляют в лабораторию, и обязательно указывается объем суточной мочи. Перед сдачей мочи на анализ нежелательно применение лекарственных веществ, так как некоторые из них (в частности, аскорбиновая кислота, входящая в состав комплексных витаминных препаратов) оказывают влияние на результаты биохимических исследований мочи.
Несоблюдение правил сбора, сроков и режима хранения проб, полученных для исследований, приводит к отрицательному результату!
Сдавайте анализы постоянно в одной и той же лаборатории – и вашему врачу будут примерно известны Ваши личные показатели нормы и любое отклонение от нормы будет сразу им замечено.

Благодарим за
обращение!
Спасибо, что помогаете нам стать лучше.
В ближайшее время наши менеджеры с Вами свяжутся.
Государственное бюджетное образовательное учреждение высшего профессионального образования
Уральский государственный медицинский университет Министерства здравоохранения Российской Федерации
Кафедра клинической лабораторной диагностики и бактериологии ФПК и ПП
ПРЕАНАЛИТИЧЕСКИЙ ЭТАП ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
Учебное пособие для студентов III курса Специальности 060105.65 — Медико-профилактическое дело
Преаналитический этап лабораторных исследований (учебное пособие) – Екатеринбург: УГМУ, 2014. — 17 с.
Составитель: Петухова М.А.
Учебное пособие содержит информацию об условиях и правилах сбора биологического материала для наиболее распространенных в клинической практике исследований мочи и кала, технологии взятия венозной и капиллярной крови.
Предназначено для студентов, изучающих цикл медико-профилактических дисциплин. Пособие будет полезно при подготовке к производственной практике «Помощник лаборанта клинических лабораторий лечебно-профилактических учреждений и лабораторий учреждений, осуществляющих свою деятельность в целях обеспечения государственного санитарно-эпидемического надзора».
Рецензент – доктор мед. наук, проф. В.В. Базарный

Введение. Структура лабораторного теста
За последние годы, благодаря внедрению современных технологий в клиническую практику, существенно возросла роль лабораторных исследований в диагностике и оценке эффективности лечения различных заболеваний. Лабораторные тесты нередко являются более чувствительными показателями состояния пациента, чем его самочувствие и параметры других диагностических методов. Важные решения врача по ведению пациента часто опираются на лабораторные данные. В связи с этим приоритетной задачей современной клинической практики является обеспечение высокого качества и достоверности результатов лабораторных исследований.
Лабораторно-диагностическое исследование подразделяется на 3 этапа:
1.Преаналитический этап частично проводится вне лаборатории и включает в себя:
∙прием пациента врачом, назначение необходимых лабораторных исследований
∙заполнение бланка-заявки на исследование
∙получение пациентом инструкций об особенностях подготовки к сдаче анализов или сбору материала
∙взятие проб биоматериала
∙доставка материала в лабораторию
∙приём материала в лабораторию
∙регистрация
∙обработка
∙подготовка к проведению исследования
2.Аналитический этап проходит непосредственно в лаборатории и состоит из следующих процедур:
∙Подготовка анализаторов, реактивов, калибраторов к проведению исследований
∙калибровка анализаторов
∙проведение внутрилабораторного контроля качества
∙непосредственно проведение исследований
∙обработка полученных результатов, их регистрация
∙написание заключения по результатам исследований
3.В постаналитический этап входит:
∙доставка результатов исследования врачу
∙оценка результатов анализа
∙использование результатов анализа в обосновании диагноза и лечения. На преаналитический этап приходится до 60% времени, затрачиваемого на
лабораторные исследования. Ошибки на этом этапе неизбежно приводят к искажению результатов анализов. Помимо того, что лабораторные ошибки чреваты потерей времени и средств на проведение повторных исследований, их более серьезным следствием может стать
неправильный диагноз и неправильное лечение. Правильности выполнения процедур преаналитического этапа следует уделять особенное внимание, т.к. неправильно взятый биоматериал для исследования непригоден.
На результаты лабораторных исследований могут влиять факторы, связанные с индивидуальными особенностями и физиологическим состоянием организма пациента, такие как: возраст; раса; пол; диета и голодание; курение и употребление алкогольных напитков; менструальный цикл, беременность, менопаузальный статус; физические упражнения; эмоциональное состояние и психический стресс; циркадный и сезонные ритмы; климатические и метеорологические условия; прием фармакологических препаратов, положение тела при взятии крови. Присутствие всех влияющих на результат анализа факторов необходимо зафиксировать, чтобы избежать ошибочной интерпретации результатов исследования. Поскольку результаты лабораторных тестов зависят от того, как пациент был подготовлен к исследованию, необходимо добиваться того, чтобы каждый человек собирающий биоматериал на анализ был должным образом проинструктирован.
Правила сбора мочи
Для общего анализа мочи рекомендуется использовать утреннюю, самую концентрированную порцию мочи. При этом придерживаются правил:
1.Сбор мочи проводит сам больной. Собирается вся порция мочи натощак сразу после сна. Желательно, чтобы предыдущее мочеиспускание было не позже, чем в 2 часа ночи.
2.Для сбора мочи используется чистый широкогорлый сосуд с крышкой.
3.Собирать мочу надо сразу в посуду, в которой она будет доставлена в лабораторию. Мочу из судна, горшка брать нельзя, так как даже после их прополаскивания сохраняется осадок фосфатов, способствующих разложению мочи
4.Перед сбором мочи предварительно необходимо провести тщательный туалет
|
наружных |
половых органов. |
5.Мужчины при мочеиспускании должны полностью освободить наружное отверстие мочеиспускательного канала, оттянув кожную складку. Женщинам следует раздвинуть половые губы и перед мочеиспусканием тщательно протереть влажным тампоном область мочеиспускательного канала.
6.Интервал между сбором мочи и доставкой в лабораторию должен быть как можно меньше.
7.Моча, собранная для общего анализа, может храниться до выполнения исследования не более 1,5-2 часов, обязательно в холодном месте. Применение
|
консервантов нежелательно, но |
допускается, если между мочеиспусканием и |
|
исследованием проходит более |
двух часов. |
8. Во время месячных мочу не исследуют. После цистоскопии анализ мочи можно назначить не ранее чем через 5-7 суток.
Если в лабораторию доставляется не вся собранная моча, то перед сливанием ее части необходимо тщательное взбалтывание, чтобы осадок, содержащий форменные элементы и кристаллы, не был утрачен.
Для пробы Нечипоренко собирают среднюю порцию утренней мочи.
Мочу для пробы Зимницкого собирают в течение суток каждые 3 часа в отдельные ёмкости. В 6 часов утра обследуемый опорожняет мочевой пузырь (эта порция для анализа не используется). Затем каждые 3 часа (до 6 часов утра следующего дня) собирается моча в 8
отдельных бутылок. Проба проводится при обычном питьевом режиме, но желательно, чтобы количество выпитой жидкости за сутки не превышало 1-1,5л.
Сбор суточной мочи для биохимического анализа:
•Собирается моча за сутки.
•Первая утренняя порция мочи удаляется, засекается время.
•Все последующие порции мочи, выделенные в течение дня, ночи и утреннюю порцию, собранную через 24 часа, в аналогичное время следующего дня, собирают в одну емкость, которая хранится в прохладном месте (+4 +8) в течение всего времени сбора.
•После завершения сбора мочи точно измерить объем собранной мочи, обязательно перемешать и сразу же отлить пробу мочи (не больше 15 мл) в небольшой контейнер. Этот контейнер доставить в лабораторию для исследования.
•На направительном бланке нужно указать суточный объем мочи (диурез) в миллилитрах, например: «Диурез 1250 мл». Если назначена проба Реберга (клиренс креатинина), отметить также рост и вес.
Правила сбора кала
Кал для исследования необходимо собирать после самопроизвольной дефекации в чистую сухую и достаточную по объёму посуду. Нельзя допускать контакта кала с мочой, брать кал для анализа из под воды, Не рекомендуется брать кал во время менструации, после приема бария, масляных клизм, приема энтеросорбентов и медикаментов, влияющих на перистальтику кишечника, после введения в анальное отверстие свечей, употреблении касторового или вазелинового масел.
Подготовка пациента:
Для копрологического исследования пациент должен 2-3 дня находиться на определенной диете: Шмидта или Певзнера. Пациент собирает кал на 3-5-е сутки с момента назначения диеты.
Диета Шмидта: 1-1,5 л молока, 2-3 яйца всмятку, 125 г слабо прожаренного рубленого мяса, 200-300 г картофельного пюре, слизистый отвар ( 40 г овсяных хлопьев), 100 г белого хлеба или сухарей, 50 г масла. Калорийность 10467 кДж. В норме остатки пищи в кале не обнаруживаются.
Диета Певзнера: 400 г хлеба, из них 200 г черного, 250 г жареного мяса, 100 г масла, 40 г сахара, гречневая и рисовая каши, жареный картофель, морковь, салат, квашеная капуста, компот из сухофруктов, свежие яблоки. Калорийность — 13607 кДж.
При назначении анализа на скрытую кровь пациент в течении трех дней перед исследованием находится на молочной диете. Ему необходимо исключить из рациона мясо, рыбу, яйца, зелёные овощи. Он не должен чистить зубы, чтобы механическое травмирование десен не стало причиной поступления крови в кишечник.
Для паразитологического исследования пациент за 3-4 дня должен исключить из рациона грубую клетчатку (бананы, картошку, капусту); выпечку с маком, кунжутом,тмином, семечками; не принимать антациды, энтеросорбенты, слабительные, препараты железа, висмута, алюминия, не подвергаться процедурам на ЖКТ.
Соскоб на энтеробиоз проводят утром, всегда до проведения гигиенических проуедур (подмывание, душ) и до дефекации. Отрезок клейкой ленты фиксируют на шпателе клеевой стороной наружу и делают несколько отпечатковсо складок перианальной области и ануса, после чего аккуратно приклеивают ленту на предметное стекло. Последующая микроскопия проводится без покровного стекла, непосредственно через клейкую ленту.
Требования к транспортировке образцов кала
Посуда в которой кал транспортируется и хранится должна быть одноразовой, изготовлена из прозрачного или полупрозрачного неокрашенного материала (стекла или пластика) с плотно завинчивающейся крышкой, не должна содержать остатков моющих средств. На наклеенной этикетке обязательно помимо данных пациента указывается дата и время сбора пробы. Не допускается собирать кал в посуду с узким горлом, использовать картонные и спичечные коробки, незакрытые ёмкости.
Полученный материал нужно доставить в лабораторию как можно скорее. Некоторые виды паразитологических исследований рекомендуется выполнять не позднее 1 часа с момента сбора фекалий. При невозможности немедленного исследования материал можно сохранять с применением консерванта в холодильнике (t +4-5 ºC). Кал заливается консервантом в соотношении 1:1 или 1:2, тщательно перемешивается одноразовой пластиковой палочкой. В качестве консервирующей жидкости используется жидкость Барбагалло (3 мл формалина 40% + 97 мл физиологического раствора).
Правила взятия и транспортировки крови на исследование
Прием пищи, особенно насыщенной жирами, может вызвать изменения результатов биохимических исследований. Кроме того, содержание многих компонентов в крови изменяется в течение дня, поэтому кровь для выполнения лабораторных исследований рекомендуется сдавать утром натощак (после 8-12 часов голодания). Как правило кровь берется между 7 и 9 часами утра, в случае необходимости исследования в вечерние часы в бланке анализа указывают время взятия крови. Перед взятием крови на исследование пациент должен воздержаться от физических нагрузок, приема алкоголя и лекарств, курения, изменений в питании на протяжении 24 часов до взятия крови. Желательно избегать волнений и стрессов.
∙Если у пациента нет возможности прийти в лабораторию утром, кровь следует сдавать после 6 часов голодания, исключив в утреннем приеме пищи жиры.
∙Строго натощак (после 12-часового голодания) следует сдавать кровь для определения параметров липидного профиля: холестерин, ЛПВП, ЛПНП, триглицериды.
∙Минимум 6-часовое голодание обязательно выдержать перед определением в крови
глюкозы, фолиевой кислоты, сывороточного железа, билирубина, калия, фосфора, желательно – и перед проведением остальных биохимических, серологических и гормональных тестов.
∙Только утром после 6-8 часов голодания (если нет особых указаний эндокринолога) следует сдавать кровь для определения С-пептида, инсулина.
∙Кровь для определения кортизола, АКТГ сдают только до 10 утра.
∙Перед взятием крови можно пить воду (но не кофе или чай)
∙Желательно за 1-2 дня до обследования придерживаться стандартной диеты, не курить, исключить из рациона алкоголь.
∙Если нет конкретных указаний лечащего врача, кровь на анализ следует сдавать до
начала приема лекарственных препаратов (например, антибактериальных и химиотерапевтических) или не ранее через 10-14 дней после их отмены. Исключение составляют случаи, когда хотят исследовать концентрацию принимаемых лекарств в крови, например, противосудорожных препаратов, или контролируют эффект принимаемых препаратов – например, непрямых антикоагулянтов. О приеме любых лекарственных препаратов и пищевых добавок следует предупредить лечащего врача
для исключения неправильной интерпретации результатов.
∙Исследование крови следует проводить до или через несколько дней после
рентгенографии, ректального исследования, физиотерапевтических процедур и других медицинских манипуляций.
∙При проведении гормональных исследований у женщин репродуктивного возраста
(примерно с 12-13 лет и до наступления климактерического периода) на результаты влияют физиологические факторы, связанные со стадией менструального цикла. Поэтому при подготовке к обследованию на гормоны ФСГ, ЛГ, пролактин, эстриол, эстрадиол, прогестерон следует указать фазу цикла (если нет особых указаний лечащего врача, обычно, эти исследования проводят на 5-7 дни цикла)
Венозная кровь является лучшим материалом для выполнения гематологических исследований с помощью автоматических анализаторов, для биохимических и ряда иммунологических исследований, для определения показателей свертываемости крови. Капиллярную кровь используют преимущественно при проведении гематологических исследований ручными методами, а также при массовых профилактических обследованиях.
Показания для взятия крови из пальца на клиническое исследование крови:
—при ожогах, занимающих большую площадь поверхности тела пациента;
—при наличии у пациента очень мелких вен или когда они труднодоступны;
—при выраженном ожирении пациента;
—при установленной склонности к венозному тромбозу;
—у новорожденных.
Транспортировать пробирки с кровью в лабораторию нужно в специальных контейнерах с крышками в вертикальном положении в штативах, избегая встряхивания. Оптимальное время исследования крови — в интервале от 1 до 4 ч после взятия. В промежутке от 5 до 30 мин происходит временная адаптация тромбоцитов к антикоагулянту и их агрегация, что может привести к ложному занижению их количества. Мазки рекомендуется делать не позднее 1-2-х часов после взятия крови. Кровь нельзя замораживать. Непосредственно перед проведением анализа кровь тщательно перемешивают.
Взятие капиллярной крови
Стол на котором производится забор крови должен быть покрыт стеклом или пластиком. На рабочем месте должно быть удобно расположено всё необходимое:
∙70% спирт
∙стерильные одноразовые скарификаторы и ватные шарики
∙предметные и разводное стекла
∙марлевые салфетки
∙пипетка Сали на 0,02 мл, стаканчик с физиологическим раствором
∙5% цитрат натрия
∙штатив с предварительно разлитыми реактивами для определения эритроцитов (4мл
физиологического раствора), гемоглобина (5мл трансформирующего раствора) и лейкоцитов (0,4мл 3% раствора уксусной кислоты), штатив с пустыми пробирками для СОЭ
∙ёмкость с дезинфицирующим раствором для сброса использованных капилляров
салфеток и стекол, отдельную одноразовую подлежащую автоклавированию ёмкость для использованных скарификаторов и ватных шариков
∙резиновые груши
∙карандаш для надписывания мазков
∙стекло с лункой или пластиковые ячейки для внесения крови
∙Непосредственно перед взятием крови капилляр Панченкова ополаскивают 5% цитратом
натрия, набирают этим капилляром цитрат до метки 75мм и помещают в пробирку для последующего определения СОЭ
При заборе крови обязательно используется маска, защитные очки, фартук и резиновые перчатки. После каждого пациента резиновые перчатки меняют или протирают дезраствором, дезинфицируют поверхность стола.
Порядок взятия крови:
1.Проверяют направление пациента на анализ, проставляют на бланке номер
2.Безымянный палец пациента протирают тампоном, смоченным 70% спиртом, дают спирту испариться, чтобы кровь не растекалась по пальцу
3.Скарификатор-копье ставят поперек кожных линий и, одновременно сжимая палец левой рукой, делают глубокий прокол
4.Первую выступившую каплю удаляют ватным тампоном, последующие используют для исследования. При недостаточном поступлении крови допускается легкое ритмичное надавливание на палец. Силой выдавливать кровь из ранки не следует, т. к. при этом вместе с кровью будет выходить тканевая жидкость и результаты исследования будут искажены.
5.Делают мазки крови для подсчета лейкоцитарной формулы
6.Набирают кровь капилляром Панченкова до метки 0мм и сливают в пробирку с цитратом, перемешивают
7.Тем же капилляром Панченкова набирают кровь до метки 0 или с избытком и помещают на стекло или в лунку, капилляр помещают в пробирку с цитратной кровью
8.Пипеткой Сали с резиновой грушей быстро отмеряют по 0,02 мл крови, по необходимости удаляя избыток крови салфеткой и сливают:
∙в пробирку для определения количества эритроцитов, перемешивают
∙в пробирку для определения гемоглобина, перемешивают
∙в пробирку для определения лейкоцитов, перемешивают
Споласкивают пипетку Сали физраствором и вытирают
9.Капилляром Панченкова набирают цитратную кровь до метки 0 и помещают в штатив для определения СОЭ
10.Надписывают мазки
11.Готовят рабочее место к приему следующего пациента.
Вся процедура взятия крови не должна занимать больше 2-3-х минут.
Взятие венозной крови
Для взятия венозной крови в настоящее время применяются три метода: забор с помощью шприца, забор самотеком с помощью иглы и взятие крови с помощью вакуумных систем.
Традиционные и широко используемые способы взятия крови с помощью иглы и/или шприца оказываются основными источниками лабораторных ошибок, приводящих к низкому качеству результатов анализов. Кроме того, эти методы не могут быть стандартизованы и не обеспечивают безопасность пациента и персонала, берущего кровь.
При взятии проб венозной крови методом самотека с использованием иглы и обычных пробирок высока вероятность попадания крови пациента на руки медицинского персонала. В этом случае руки медицинской сестры могут стать источником передачи и распространения возбудителей гемоконтактных инфекций другому пациенту путем контаминации кровью инъекционной ранки. Медицинский работник сам может заразиться от источника инфекции.Использование медицинского шприца с иглой для взятия крови следует также избегать из-за его недостаточной безопасности для медицинского персонала и

невозможности исключения гемолиза крови при переносе пробы под давлением в пробирку.
Для взятия проб венозной крови наиболее предпочтительно использовать вакуумсодержащие системы . Этот способ имеет ряд преимуществ, основным из которых является то, что кровь попадает непосредственно в закрытую пробирку, предотвращающую любой контакт медперсонала с кровью пациента.
Рис. 1. Строение вакуумной системы для взятия крови (на примере Vacuteiner)
Одноразовая закрытая вакуумная система (рис. 1) состоит из трех основных элементов:
∙Стерильной одноразовой вакуумной пробирки с дозированным уровнем вакуума и
различными наполнителями, с крышкой, защищенной пластиковым колпачком с цветовым кодом, соответствующим типу содержащегося реагента.
∙Стерильной одноразовой двухсторонней иглы с мембраной, закрытой с двух стороон
защитными колпачками, предназначенной для взятия крови в несколько пробирок за одну венепункцию.
∙Одноили многоразового держателя.
Под действием вакуума кровь всасывается из вены через иглу в пробирку и сразу же смешивается с химическим реактивом – антикоагулянтом. Тщательно дозированная величина вакуума обеспечивает достижение точного соотношения между кровью и реагентами в пробирке.
Преимущества вакуумной системы для взятия крови
∙стандартизация условий взятия крови и процесса пробоподготовки; количество
внесенного в пробирку антикоагулянта точно соответствует максимальному объему набираемой крови.
∙система готова к использованию, уменьшается количество операций по подготовке образца крови в лаборатории;
∙возможность прямого использования в качестве первичной пробирки в целом ряде
автоматических анализаторов (экономия на приобретении вторичных пластиковых пробирок);
∙герметичные и небьющиеся пробирки упрощают и делают безопасным процесс транспортировки и центрифугирования проб крови;
∙четкая идентификация пробирок, используемых для различных типов анализов, за счет цветной кодировки крышек;
∙сокращение затрат на приобретение центрифужных пробирок, на мойку, дезинфекцию и стерилизацию пробирок;
∙простая методика обучения персонала;
∙уменьшение риска профессионального инфицирования;
∙экономия времени в процессе взятия крови;
∙сменяемые в процессе процедуры пробирки дают возможность взять кровь на все
назначенные виды исследований «в один прокол»
∙процедура взятия крови комфортнее для пациента
∙простота конструкции вакуум-содержащих систем и их надежность.
Порядок взятия венозной крови:
Оснащение необходимое для взятия проб венозной крови:
1.Стол для проб крови. Возможно использование передвижного столика.
2.Подставки (штативы) для пробирок. Подставки должны быть легкими, удобными, с достаточным количеством ячеек для пробирок.
3.Подушка для выравнивания локтевого сгиба или специальное кресло для венепункции. Пациент во время венепункции должен сидеть с максимальным комфортом и безопасностью для него и быть доступным для медицинского персонала процедурного кабинета. Для проведения венепункции рекомендуется специальное кресло. Оба подлокотника кресла должны располагаться так, чтобы можно было найти оптимальную для каждого пациента позицию при венепункции. Подлокотники служат опорой для рук и не позволяют сгибать локти, что предотвращает спадение вен. Кроме того, кресло должно предохранять пациентов от падения в случае обморока.
4.Кушетка.
5.Перчатки. Одноразовые или многоразовые. Допускается многократное использование перчаток с обеззараживанием их после каждого пациента двукратным протиранием салфетками одноразового использования, пропитанными антисептиками,
Актуальность
Часто у лечащего врача возникают претензии к лабораторным анализам, т. е. происходит не совпадение клинической картины с лабораторными показателями. Нарушение преаналитики является одной из самых частых причин этой проблемы. Данная статья поможет разобраться с этой нелепой, но весьма серьезной задачей.
Что такое преаналитика? Преаналитика – это все процедуры, выполняемые до начала проведения лабораторных исследований, которые непосредственно влияют на результат лабораторного анализа.
Оптимально проведенная преаналитическая подготовка является основным условием точной и полной лабораторной диагностики.
Зачем нужно врачам знать преаналитику? При нарушении преаналитического этапа врачи собственноручно готовят предпосылки для заведомо ложных результатов лабораторного анализа.
Статистика
Затраты времени на этапах лабораторного исследования:
Преаналитическии этап вне лаборатории – 20,20%
Преаналитическии этап в лаборатории – 37,10%
Аналитическии этап – 25,10%
Постаналитическии этап – 13,60%
Отправка результатов – 4%
Анализ ошибок показывает, что около 40% ошибок совершается на преаналитическом этапе при выполнении исследований в плановом порядке и около 60% ошибок происходит на преаналитическом этапе при неотложных анализах. (M.Plebani, P.Carraro, 1997).
Из чего состоит преналитическии этап вне лаборатории?
— Назначение анализов
— Подготовка пациента (психологическая и физическая)
— Заполнение направления.
— Взятие биоматериала.
— Хранение и доставка биоматериала.
На каждом из выше указанных составных может быть допущена ошибка.
Общие правила при подготовке к исследованию крови:
1. Кровь сдается в утренние часы натощак (или в дневные и вечерние часы, спустя 4-5 часов после последнего приема пищи). За 1-2 дня до исследования исключить из рациона продукты с высоким содержанием жиров.
2. Показатели крови могут существенно меняться в течение дня, поэтому рекомендуется все анализы сдавать в утренние часы.
3. Накануне исследования (в течение 24 часов) исключить алкоголь, интенсивные физические нагрузки, прием лекарственных препаратов (по согласованию с врачом).
4. За 1-2 часа до сдачи крови воздержаться от курения, не употреблять сок, чай, кофе, можно пить негазированную воду. Исключить физическое напряжение (бег, быстрый подъем по лестнице), эмоциональное возбуждение. За 15 минут до сдачи крови рекомендуется отдохнуть, успокоиться.
5. Не следует сдавать кровь для лабораторного исследования сразу после физиотерапевтических процедур, инструментального обследования, рентгенологического и ультразвукового исследований, массажа и других медицинских процедур.
6. При контроле лабораторных показателей в динамике рекомендуется проводить повторные исследования в одинаковых условиях – в одной лаборатории, сдавать кровь в одинаковое время суток и пр.
7. Кровь для исследований нужно сдавать до начала приема лекарственных препаратов или не ранее, чем через 10 — 14 дней после их отмены. Для оценки контроля эффективности лечения любыми препаратами нужно проводить исследование спустя 7 – 14 дней после последнего приема препарата. Если Вы принимаете лекарства, обязательно предупредите об этом лечащего врача.
Общие правила применимы ко всем анализам, но для некоторых исследований требуется специальная подготовка и дополнительные ограничения.
Влияние некоторых факторов на результат анализов.
Психический стресс
Степень влияния психического стресса (страх перед взятием крови, предоперационный стресс и т.д.) на лабораторные результаты часто недооценивается. Между тем, под его влиянием может наблюдаться увеличение секреции гормонов (альдостерона, ангиотензина, катехоламинов, кортизола, пролактина, ренина, соматотропина, ТСГ, вазопрессина) и повышение концентрации альбумина, фибриногена, глюкозы, инсулина, лактата и холестерина.
Наложение жгута
Что происходит, когда жгут накладывается на весь период времени при взятии пробы? При использовании давления ниже уровня систолического, внутри капилляров поддерживается эффективное фильтрационное давление. Как следствие, жидкость и низкомолекулярные соединения перемещаются из внутрисосудистого пространства в интерстициальное. Макромолекулы, вещества, связанные с белками и клетки крови не проникают через стенку капилляров, таким образом, их концентрация заметно возрастает, тогда как концентрации низкомолекулярных веществ не изменяются.
Длительность наложения жгута и изменения уровней исследуемых параметров
Сравнение: через 1 мин. через 3 мин.
Параметры Отклонение в %
Билирубин +8
Холестерин +5
Креатинин -9
Креатинкиназа -4
Железо +7
Глюкоза -9
γ-Глютамилтрансфераза -10
Калий +5
Положение тела
Изменение положения тела – из горизонтального в вертикальное – приводит к увеличению уровня ряда показателей.
Параметры Увеличение в %
Гематокрит 13
Эритроциты 15
Холестерин высокой плотности 10
Альдостерон 15
Ренин 60
Взятие пробы из катетера
Если пробы берут из венозных или артериальных инфузионных катетеров, канюлю следует промыть изотоническим солевым раствором в объеме, соизмеримом с объемом катетера. Прежде чем взять пробу, выбросить первые 5 мл крови, полученной из катетера. Взятиепроб для исследований свертывающей системы из катетеров, обработанных гепарином, неприемлемо. Для гепарин-зависимых методов (тромбиновое время, АЧТВ) рекомендуется
предварительно отбросить объем крови, вдвое превышающий объем катетера; первая порция взятой затем крови может быть использована для выполнения исследований, не относящихся к системе гемостаза; последующая порция цитратной крови может использоваться только для определения нечувствительных к присутствию гепарина аналитов: протромбинового времени, рептилазного времени, фибриногена по Clauss, АТ III, мономеров фибрина. Важно, чтобы перед взятием крови в пробирку с раствором цитрата натрия не было длительной паузы, в течение которой кровь в катетере может «застаиваться».
Высота над уровнем моря
Содержание некоторых компонентов крови подвержено значительным изменениям в зависимости от высоты над уровнем моря. С увеличением высоты значительное повышение наблюдается в отношении, например реактивного белка (до 65% на высоте 3600 м), гематокрита и гемоглобина (до 8% на высоте 1400 м) и мочевой кислоты. Адаптация к высоте занимает недели, а возвращение к значениям на уровне моря происходит в течение нескольких дней. Значительное снижение величин с ростом высоты над уровнем моря обнаружено в отношении мочевого креатинина, клиренса креатинина, эстриола (до 50% на высоте 4200 м), осмоляльности сыворотки, ренина плазмы и трансферрина сыворотки.
1 Мошкин А., Долгов В. Обеспечение качества в клинической лабораторной диагностике.. — М.: 2004. – С. 26-43.
2 Преаналитический этап. Пробоподготовка. West Medica
3 Преаналитика: практические советы и методы. SARSTEDT AG & Co.
Түйін: преаналитикалық кезенде көптеген факторлар зертханалық зертудің нәтижесіне әсер ететің зертхана дәрігерлері жақсы түсінеді. Ал клиникалық дәрігердің көбісі бұл жағдайдың маңызың ескермейді. Осы салалардың әсерінен зертханалық зертудің нәтижесін дәрігерлер дұрыс талдамауына және дұрыс ем шара жасамауына алып келеді.
Resume: physicians of Clinical Laboratory Diagnostics had recognized that, in the preanalytical phase, many factors can affect to the results of laboratory tests. Most of physicians don’t know of their influence. Ignorance of this factors may lead to misinterpretation of the result and take on a patient the wrong action.
Согласно данным ВОЗ, удельный вес лабораторных анализов составляет 75–80 % от общего числа диагностических исследований, выполняемых в медорганизациях.
Служба значительно эволюционировала: если раньше лаборатория была придатком в поиске факторов риска, постановке диагноза, назначении лечения, то сегодня она является объединяющим механизмом на всех этапах взаимодействия врача и пациента. Централизация лабораторных исследований — мировая тенденция реформирования клинической лабдиагностики. Особое значение имеет преаналитический этап клинических лабораторных исследований.
Лабораторная диагностика
Важная составляющая
Основной целью централизации лабораторных исследований является повышение эффективности лечебно-диагностического процесса за счет расширения объема лабораторной, диагностически значимой информации, которая поступает лечащим врачам из централизованной лаборатории.
Согласно постановлению коллегии Минздрава от 25.07.2018 № 14.4 «О совершенствовании работы службы лабораторной диагностики», централизация лабораторий, направленная на увеличение доступности лабораторных исследований, определена основным стратегическим моментом развития службы клинической лабораторной диагностики страны.
Важнейшей составляющей централизации является процесс взаимодействия с внешним заказчиком (медучреждением) на преаналитическом этапе оказания лабораторных услуг. Преаналитический этап включает прием пациента врачом, назначение лабораторных исследований, заполнение бланка направления, получение пациентом инструкций об особенностях подготовки к сдаче анализов или сбору биологического материала, взятие проб, доставку материала в лабораторию.
При централизации для лаборатории существенно увеличивается число пунктов сбора проб биологического материала, значительно расширяется спектр заказываемых тестов, изменяется структура проб биологического материала, ритм и временной период их поступления в лабораторию.
Взаимодействие централизованной лаборатории с заказчиком на преаналитическом этапе предполагает обучение врачей, медсестер, курьеров, обеспечение их инструкциями по подготовке пациентов к лабораторным исследованиям, правилам взятия, сбора и подготовки проб к транспортировке, организацию логистики доставки. Порядок организации взятия проб биологического материала и доставки его в централизованную лабораторию является одним из важнейших моментов обеспечения правильного взаимодействия лаборатории и учреждения здравоохранения.
Централизация лабораторных исследований предусматривает особые требования к организации преаналитического этапа, строгое выполнение которых позволит обеспечить получение качественных результатов. Любые неточности на этапе назначения лабораторных исследований будут существенным образом снижать эффективность лечебно-диагностического процесса.
Большинство ошибок в процессе лабораторного анализа — от назначения теста до интерпретации результатов — происходит до того, как образец попал в лабораторию, т. е. вне прямого контроля лаборатории. По данным различных исследований, на преаналитический этап приходится от 46 % до 68 % всех лабораторных ошибок.
Наиболее частые ошибки преаналитического этапа:
- отсутствие образца или перечня назначенных исследований;
- ошибки идентификации образца (этикетка,сопроводительный документ);
- гемолиз in vitro (в пробирке);
- сгустки в образце крови/плазмы;
- неправильная пробирка/контейнер;
- недостаточное количество образца (объем пробы);
- неправильное соотношение кровь/антикоагулянт;
- недостаточное перемешивание образца после взятия;
- неадекватные условия хранения и транспортировки;
- неправильный режим центрифугирования (время/скорость).
Рекомендации
При определении приемлемости выявленных ошибок рекомендуется использовать целевые уровни индикаторов качества преаналитического этапа, установленные Международной федерацией клинической химии и лабораторной медицины (IFCC). Ошибки преаналитического этапа могут существенно исказить состав или свойства биологического материала и таким образом существенно снизить диагностическую ценность результата лабораторного исследования. Частота таких ошибок зависит от уровня технологической дисциплины в направляющей организации здравоохранения, качества администрирования этого этапа.
Основные причины большого количества ошибок:
- отсутствие стандартов качества выполнения процедур преаналитического этапа;
- неиспользование для взятия и сбора биоматериала одноразовых безопасных приспособлений по причине существующего ложного представления об их высокой стоимости;
- недостаточные знания и качество обучения среднего медперсонала правилам и технике выполнения процедур преаналитического этапа.
Прогресс лабораторных технологий, оснащение медицинской лаборатории современными автоматическими анализаторами позволили получать существенно более точные результаты анализов. Новые автоматические анализаторы весьма чувствительны к качеству исследуемого биоматериала, что предъявляет более высокие требования к условиям взятия, хранения и срокам доставки проб.
Согласно приказу Минздрава от 18.04.2019 № 466 «О совершенствовании деятельности службы лабораторной диагностики Республики Беларусь», обеспечение качества преаналитического этапа лабораторных исследований является зоной ответственности клинических специалистов. В стандарте СТБ ISO 15189-2015 «Медицинские лаборатории. Требования к качеству и компетенции» требуется установление индикаторов качества с целью мониторинга и оценки работы по всем критическим аспектам преаналитического этапа. Их внедрение в лабораторную практику и систематический сбор данных позволят обеспечить надежность результатов лабораторного тестирования.
Внутренний стандарт
Клинико-диагностическая лаборатория (КДЛ) РНПЦ РМиЭЧ является многопрофильной, с 2016 года выполняет централизованные исследования для взрослых и детей Новобелицкого и Советского районов Гомеля. Заказчиками являются 10 поликлиник. Исследования включают широкий спектр биохимических (специфических белков и метаболитов), иммунохимических (гормоны, онкомаркеры, витамины и др.), коагулологических (коагулограмма, агрегатограмма, факторы свертывания и антикоагулянты, D-димеры и др.) лабораторных тестов.
Разработан внутренний стандарт, который был включен в текст совместного приказа РНПЦ РМиЭЧ и ГУЗО Гомельского облисполкома (№ 117 и № 167 от 05.02.2019) «О централизации лабораторных исследований». Определена схема проведения централизованных лабораторных исследований.
Для обеспечения доступности для врачей-клиницистов информации о полном спектре выполняемых тестов сотрудниками лаборатории разработаны бланки направлений.
Для обеспечения контроля качества выполнения централизованных исследований лаборатория постоянно анализирует результаты применения основных индикаторов качества преаналитического этапа:
- ошибки идентификации и транскрипции тестов;
- несоответствие направления установленной форме;
- неверный тип, недостаточный объем образца;
- повреждение образца/направления в ходе транспортировки;
- образец, направление для образца не получены;
- сгусток в образце.
По результатам анализа, проведенного КДЛ РНПЦ РМиЭЧ, несоответствия в целом выявляются для 1,3 % доставленных образцов сыворотки/плазмы. Среди индикаторов с наибольшей частотой встречаются ошибки транскрипции тестов, составляющие 1 %:
- отсутствие отметок о необходимых тестах;
- нечеткий запрос на исследование;
- незаполненные/не полностью заполненные паспортные данные пациента (не обозначен пол, возраст, не указан диагноз, отсутствует печать врача).
Реже определяются ошибки идентификации пробы — нарушение маркировки, в т. ч. расхождения между нумерацией направления и пробы. В 0,34 % случаев пробы не доставлялись в лабораторию, в 0,3 % — для проб отсутствовали направления на исследования. Несмотря на то что выбраковка по причине гемолиза определена на этапе взятия крови и первичной пробоподготовки, в лабораторию в 0,31 % случаев доставляются гемолизированные образцы. В 0,5–1 % случаев в пробах сыворотки встречаются нити фибрина, сгустки, осадок эритроцитов. Регистрируются случаи доставки количества сыворотки, недостаточного для выполнения назначенных тестов. Такие несоответствия являлись результатом неполного соблюдения поликлиниками правил пробоподготовки: выдержки необходимого времени сворачивания крови, соблюдения режима центрифугирования крови и пипетирования сыворотки.
Для образцов сыворотки с выявленными ошибками транскрипции тестов лаборатория выясняет необходимую информацию по телефону, после чего образцы, как правило, принимаются в работу. Указанные действия позволили минимизировать потери образцов по причине нарушений правил преаналитики. Выбраковка с оформлением акта отказа в приеме биологического материала с объяснением причин проводится для гемолизированных образцов либо для случаев, когда доставляется только проба сыворотки без направления и наоборот. Пробы сыворотки со сгустками, эритроцитами подвергаются повторному центрифугированию, после чего выполняются исследования.
Лабораторная практика традиционно делится на три этапа: преаналитический, аналитический и постаналитический.
Преаналитическая фаза включает в себя правильный отбор образцов, предоставление информации о пациенте, сбор и маркировку образцов, обработку образцов, сортировку, титрование и центрифугирование. Любой из этих шагов может быть пропущен, что приведет к неточным результатам, которые приписываются преаналитической фазе.
Преаналитические ошибки при исследовани общего анализа крови чаще всего вызваны неверным пониманием запроса на анализ, неправильной маркировкой, контаминацией места отбора, гемолизом, сгустками, недостаточным количеством образцов, проблемами хранения и несоответствующей пропорцией крови к антикоагулянту или неправильным выбором антикоагулянта.
Общая частота неточностей в лабораторных работах, согласно G. Lippi et.al. (2010), варьируется от 0,1% до 3,0%. Считается, что преаналитические ошибки составляют от 46% до 68,2% ошибочных диагнозов, в то время как аналитические ошибки, которые были в центре внимания более ранних исследований, составляют лишь около 10% всех ошибочных диагнозов (Hammerling J., 2013). Кроме того, преаналитические ошибки составляют от 18,5% до 47% всех лабораторных ошибок.
Наиболее распространенными преаналитическими ошибками являются отсутствие медицинской информации, неподходящие контейнеры и потерянные образцы.
Несмотря на то, что существуют международные стандарты отбора проб крови и стандартизации процесса тестирования, соблюдение руководящих принципов здесь крайне низкое, особенно тогда, когда лабораторный персонал не привлекается, а медсестры или врачи выполняют забор крови, частота преаналитических ошибок становится очень высокой.
Кроме того, критерии отбраковки образцов различаются в разных лабораториях. Не хватает профессиональных данных по отчетности, анализу первопричин и стратегиям предотвращения лабораторных ошибок (Lima-Oliveira G, et.al., 2012).
Наиболее распространенной преаналитической ошибкой являются изменения условий хранения из-за задержки при транспортировке, на которые приходится 19,45%, за которыми следуют пробы, забракованные из-за неверных медицинских записей- 19,16%. Общее количество забракованных разбавленных проб составляет 16,35%, а количество забракованных проб из-за неправильных пробирок составляет 16,01%). Отклоняется гемолизированных образцов — 15,13%. Немеченые образцы отклоняются в количестве 10,01%, а образцы со сгустками составляют 3,88% от общего числа забракованных образцов (Toor N., et. al., 2023)
Низкая удовлетворенность пациентов напрямую связана с лабораторными ошибками и высокими затратами как для пациентов, так и для системы лабораторных услуг.
Негативное влияние лабораторных ошибок на лечение пациентов не ограничивается тем фактом, что они увеличивают время обработки, требуют дополнительных заборов крови и приводят к неточным диагнозам и неподходящим лекарствам; они также наносят ущерб репутации лаборатории и подрывают доверие пациентов к диагностическим услугам. Было подсчитано, что лабораторная ошибка оказывает негативное влияние на результаты лечения пациентов до 24,4% (Lippi G., et.al., 2006).
Этот процесс приводит к увеличению финансовой нагрузки на систему здравоохранения. Согласно исследованию S. Green (2013), расходы на преаналитические ошибки составляют от 0,23% до 1,2% всего операционного бюджета больниц.
Сбор крови
Количество и концентрация дикалийэтилендиаминтетрауксусной кислоты (EDTA) в пробирке для сбора крови требуют, чтобы кровь собиралась до определенной отметки на пробирке. Если собрано слишком мало крови, разбавление образца может привести и к изменению параметров. Относительный избыток EDTA в таких случаях также влияет на морфологию клеток крови.
Транспортировка крови
Транспортировка образца должна исключать высокую температуру. Фрагментация эритроцитов при этом является признаком избыточного тепла. Ложно высокое количество лейкоцитов (WBC) при высокой температуре встречается чаще, чем ложно низкое. Известно, что в определенных ситуациях гематологические анализаторы обеспечивают ложное PLT, когда истинное количество тромбоцитов является адекватным.
Физиологические и физические факторы, влияющие на показатели общего анализа крови
Несколько физиологических и физических факторов могут повлиять на результаты CBC и затруднить установление референтных значений. Физиологические факторы включают возраст, этническую принадлежность, пол, сезон, время суток, питание, болезни, стресс, травмы др.
К важным физическим факторам относятся место забора крови, наличие и тип антикоагулянта, а также обработка и подготовка образцов (Dyer D.Cervasio S.,2008). Любая интерпретация результатов должна учитывать эти факторы.
Преаналитические ошибки результатов общего анализа крови
Потеря образца
Отсутствие полноценного запроса на анализ
Неправильная маркировка (19,16% преаналитических ошибок)
Сбор крови
Контаминация места, в котором производится забор крови
Недостаточное количество образца крови
Неправильный выбор антикоагулянта, относительный избыток или дефицит EDTA (16,45% преаналитических ошибок)
Неправильные пробирки (16,01%)
Гемолиз in vitro (15,13% преаналитических ошибок)
Наличие сгустков крови (3,88% преаналитических ошибок)
Транспортировка
Задержка транспортировки (19, 45% преаналитических ошибок)
Неподходящие контейнеры
Высокая температура окружающей среды при транспортировке
<RBC (фрагментация эритроцитов)
WBC >
Неправильное хранение
Высокая температура окружающей среды при хранении
<RBC (фрагментация эритроцитов)
WBC >
Первоначальное замораживание с последующим охлаждением
Нарушение срока хранения образца крови при определенной температуре
Хранение крови
Отложенный анализ проб по организационным, техническим причинам или проверке сомнительных результатов, которые необходимо уточнить — не редкость в клинической практике. Кроме того, реорганизация лабораторных служб по всему миру влечет за собой объединение небольших лабораторий в более крупные, что особенно важно в эпоху новых инициатив в области общественного здравоохранения. Большое количество образцов отправляется из периферийных центров в централизованную лабораторию на большие расстояния, тем самым происходит задержка на 12-24 часа или даже более. Более того, в выходные дни этот интервал может превышать 36 часов. Это важно уситывать в связи с тем, что CBC является наиболее часто проводимым лабораторным тестом, дающим основную и ценную информацию не только для облегчения диагностики и направления дальнейшего тестирования, но и для мониторинга состояния пациента, включая оценку эффективности терапии.
В большинстве случаев мы не можем сразу провести анализ, поэтому информацией о том, как долго мы можем хранить образцы для получения надежных результатов, должны владеть как сотрудники лаборатории, так и врачи.
В литературе большинства производителей автоматических анализаторов часто упоминается, что образцы крови, хранящиеся либо при комнатной температуре, либо при 4 ± 2°C (в холодильнике) до 24 часов, как правило, дают надежные результаты для общего анализа крови и автоматизированного дифференциального подсчета лейкоцитов. Однако, хранение при комнатной температуре может вызвать изменения этилендиаминтетраацетата (EDTA) и количественное влияние хранения на кровь, поскольку известно, что клеточные элементы обладают ограниченной стабильностью в EDTA. В то же время, было отмечено, что хранение в холодильнике крови с антикоагулянтом EDTA улучшает стабильность общего анализа крови (Gulati G., et.al., 2002).
В соответствии с рекомендациями Международного комитета по гематологической стандартизации, максимальные интервалы хранения для общего и лейкоцитарного подсчета с автоматическим дифференциальным подсчетом стабильны при 4°C в течение как минимум 24 ч или даже до 72 ч, при этом существенные различия зависят от типа автоматизированного анализатора клеток крови.
Для CBC образцы можно надежно хранить в течение 24 часов. Для более длительного хранения лучшим выбором будет охлаждение (при 4 °C). Интересно, что в некоторые моменты времени (1, 2 и 4 часа) PLT немного ниже. Хранение при 4 °C показало гораздо большую стабильность. За исключением 8 часов, до 3 дней статистических изменений не было. Преимущества холодильной камеры (4 ° C) очевидны для длительного хранения. Стоит отметить, что хранение образцов более 12 часов для метаболической панели может привести к ненадежным результатам. Разные авторы сообщают, что некоторые анализы крови стабильны до 72 часов после сбора, если хранить их при 4 ° C в холодильнике.
Повреждение эритроцитов при хранении тесно связано с их внутренним энергетическим метаболизмом. Поскольку в эритроцитах нет митохондрий, полностью зависящих от гликолиза для получения энергии, молочная кислота, образующаяся в процессе гликолиза, будет снижать внутреннее значение рН клеток, тем самым снижая уровень метаболизма клеток и уменьшая производство АТP, что приводит к снижению уровня фосфорилирования фосфопротеинов и утрате деформируемости клеточной мембраны. Снижение уровня АТP в свою очередь уменьшает синтез 2,3-дифосфоглицериновой кислоты, а уменьшение значения рН и концентрации 2-магне3-дифосфоглицериновой кислоты сдвигает кривую кислородной диссоциации гемоглобина влево. АТP также является агонистом NO-синтазы. NO и гемоглобин в эритроцитах объединяются с образованием SNOHb и Hb(Fe~II) NO, которые участвуют в транспорте и метаболизме NO. Уменьшение АТP также влияет на ионный насос на клеточной мембране, что приводит к увеличению уровня К + в депонированной крови (Li L., et.al., 2022).
Некоторые параметры, связанные с эритроцитами, такие как RBC, HB и MCHC менее стабильны при хранении при 4 °C, на что может повлиять первоначальное замораживание с последующим охлаждением (Lombardi G., et al., 2011). RDW значительно увеличивается после 24-часового хранения при комнатной температуре. Возможной причиной этого изменения может быть повышенный MCV (de Baca M., et.al., 2006).
По данным D. Gunawardena et.al. (2017) среди параметров CBC лейкоциты (WBC), эритроциты (RBC), HB, MCH, нейтрофилы и лимфоциты стабильны при всех температурах (4 ± 2°С, 23 ± 2°С и 31 ± 2°С.) до 48 часов. Моноциты, эозинофилы, MCH, HCT и SV-RDW показали статистически значимые изменения при 23 ± 2°C и 31 ± 2°C. Значительное снижение количества тромбоцитов (PLT) и увеличение MPV и количества базофилов наблюдались при всех исследуемых температурах вплоть до 48 часов.
Увеличение MPV наблюдается при всех температурах, причем этот показатель не считается очень стабильным для образцов крови, хранящихся в течение длительного времени. Его значения изменяются в первый период времени (1 час) и не имеют различий для температуры хранения (Wu D-W., et.al., 2017). Четыре дня при 4 °C изменяют морфологию, движение и агрегацию тромбоцитов (Mahmoodi M., et al., 2006). MPV может иметь отношение к изменениям формы тромбоцитов, связанным со временем и формой, от дисковидной до сферической и набухания. Возможно, что тробмоциты, которые показывают повышение MPV, не будут подсчитаны машиной как тромбоциты, а будут помечены отдельно, что приведет к снижению PLT. Это говорит о том, что лучше всего оценивать PLT в течение 6 часов после забора крови.
Во всех случаях результаты CBC обычно более стабильны, чем различные биохимические, например, метаболические панели и предоставляют надежные результаты даже через 24 часов хранения.
Эритроциты, хранящиеся с добавлением прогестерона, имеют более высокие уровни АТP, меньший спонтанный лизис, более высокую осмотическую резистентность и более высокое поглощение метиленового синего в течение времени хранения, чем клетки, хранение которых происходит без добавления прогестерона. Этот гормон, по-видимому, находится в устойчивом равновесии между плазмой и эритроцитами в течении 42 дней хранения, и его количество в плазме почти вдвое больше, чем в клетках. После повторных промываний солевым раствором около 10% прогестерона остается прикрепленным к эритроцитам. Специфическая связь прогестерона с популяциями эритроцитов различной плотности показывает, что высокая удельная активность достигается в популяциях клеток низкой плотности (молодые клетки) в течение всего времени хранения (DeVenuto F., S M Wilson S.,1976).
.
Трансфузиология
Во время хранения компонентов крови ex vivo биореактивные вещества, накопленные в среде хранения и вызвавшие изменения в эритроцитах, предоставили постоянные доказательства непрерывных изменений, приводящих к дисфункции эритроцитов и способны оказывать неблагоприятное воздействие на переливаемого хозяина (Gacko M., et.al., 2004). Удаление лейкоцитов и тромбоцитов как источника свободных радикалов в компонентах эритроцитов влияет на защиту оксидоредуктивного баланса в компонентах эритроцитов во время хранения.
Лейкоредуцирование или лейко-истощение относится к снижению количества лейкоцитов менее чем 5 × 10 6 остаточных донорских лейкоцитов в конечном продукте крови при сохранении 85% жизнеспособного исходного RBC. Наличие лейкоцитов в компонентах крови является причиной нескольких осложнений.
Лейкоредуцирование предотвращает фебрильные реакции, накопление цитокинов / хемокинов, избегая фебрильной негемолитической реакции трансфузии (FNHTR), уменьшая передачу цитомегаловируса и невосприимчивость к переливанию тромбоцитов (в концентратах тромбоцитов).
Несмотря на использование аддитивных растворов, изменения морфологии и метаболизма эритроцитов ожидаются при хранении пакетов с кровью с лейко-редукцией и без нее. Хранение эритроцитов вызывает некоторые сложные структурные и биохимические изменения, которые называются поражением хранения эритроцитов (RCSL)
Биохимические изменения включают снижение активности фермента глюкозо-6-фосфатдегидрогеназы (G6PD) в качестве антиоксидантного фермента, увеличение везикуляции эритроцитов, потеря мембран эритроцитов, лизис мембран эритроцитов, снижение уровня 2,3-дифосфоглицерата (2,3- DPG), аденозинтрифосфат (АТФ) и снижение уровня глутатионредуктазы (GSH). Эти процессы сопровождаются снижением рН, увеличением активности фермента ЛДГ и концентрацией лактата.
Эти изменения приводят к снижению функции и выживаемости эритроцитов после переливания. G6PD является важным ферментом в метаболизме эритроцитов и ключевым ферментом окислительного пентозофосфатного пути (PPP). В PPP никотинамид-аденин-динуклеотид-фосфат (NADP) превращается в его восстановленную форму, NADPH, которая необходима для GSH-опосредованной защиты от окислительного стресса поддерживая целостность эритроцитов.
Также наблюдаются некоторые биохимические изменения концентратов эритроцитов при анаэробном гликолизе. В частности, наблюдается увеличение уровней калия (K +) и лактата и одновременное снижение уровней pH, глюкозы и натрия (Na +). Время хранения не влияет на уровни кальция (Ca ++) в концентратах RBC.
Активность ферментов лактатдегидрогеназы и К + в эритроцитах значительно выше (в 20-160 раз), чем в плазме, и можно ожидать, что гемолиз приведет к увеличению этих аналитов.
Cтатистически значимое увеличение активности лактат дегидрогеназы было показано в течение периода хранения в нефильтрованных эритроцитах. Активность фермента LDH в нефильтрованном эритроците по сравнению с LR-RBC увеличилась с 14-го дня хранения и была статистически признана значимой. Такие показатели, как MCV, MCH и MCHC, меньше всего влияли на хранение. Другие авторы обнаружили, что MCV увеличился, а MCHC значительно снизился в течение периода хранения, которые оценивались каждую неделю. (Grezelbash B., et.al., 2018).
J. Latham et al. (1982) наблюдали увеличение концентрации не только лактата, лактатдегидрогеназы, но и гемоглобина во время хранения. Консистенция свободного Hb и скорость гемолиза также были выше в нефильтрованном RBC по сравнению с LR-RBC во время хранения. Эти наблюдения указывают на возможное вовлечение лейкоцитов в большее повреждение эритроцитарной мембраны и благоприятное влияние лейкоредуцирования на качество сохраняемых единиц эритроцитов. Эти различия могут быть связаны с биологически активными веществами, такими как цитокины и гистамин, которые высвобождаются из лейкоцитов во время хранения, что оказывает непосредственное воздействие на мембрану эритроцитов и приводит к некоторым структурным и биохимическим изменениям.
Согласно предложению Castro O., et.al. (2003), общая концентрация гемоглобина, лактатдегидрогеназа и концентрация лактата являются маркерами гемолиза.
Sonker А. et.al. (2014) также сообщили, что лейко-фильтрованный RBC показывает меньшее повышение K +, LDH и гемолиза к концу периода хранения по сравнению с их нефильтрованными единицами. Присутствие лейкоцитов может быть причиной усиленного окислительного стресса. Эти авторы отметили, что активность ферментов LDH, гемолиз и повреждение клеточных мембран (калий, LDH, свободный гемоглобин) усиливаются в компонентах крови с высоким содержанием лимфоцитов.
Дельта – проверки
Преаналитические ошибки, которые могут повлиять на результаты CBC, включают смешивание образцов, неправильное получение образца и нарушение целостности образца между моментом, когда образец был получен и когда он был доставлен в лаборатории.
Дельта-проверки — процесс маркировки различий в конкретных аналитах между последовательными анализами, являются одним из способов выявления таких проблем. Такие проверки эффективны при обнаружении некоторых вариантов преаналитических ошибок.
Среди обычно оцениваемых показателей CBC средний объем клеток, или MCV, и средняя концентрация клеточного гемоглобина, или MCHC, пригодны для дельта -проверок лучше всего. И тот, и другой показатель чрезвычайно стабильны в течении короткого срока — 24 часа. Например, суточный биологический коэффициент вариации MCV у здоровых людей составляет всего 0,5%. Даже в ситуациях быстрого изменения других параметров эритроцитов, таких как острое кровоизлияние, MCV и MCHC не будут значительно изменяться в течение суток, поскольку ответ ретикулоцитов на острую кровопотерю не начинается в течение первых двух-трех дней. За исключением переливания эритроцитов и редко острого внутрисосудистого гемолиза, нет неотложных ситуаций в состоянии пациента, которые бы значительно изменили эти показатели в краткосрочной перспективе. В случае острого гемолиза с гемоглобинемией, MCHC может быть изменен, в отличие от MCV, который будет оставаться стабильным.
Из других проблем, связанных с анализом образца, гемолиз образца также поддается обнаружению с помощью дельта-проверок на основе MCHC. В этом сценарии RBC уменьшается, без изменений в HB и MCV, что приводит к увеличению MCHC.
Загрязнение образцов внутривенной жидкостью и изменения количества клеток из-за свертывания образцов теоретически могут быть обнаружены дельта-проверками HB и HCT, а также изменениями значений RBC, WBC и PLT. Однако нецелесообразно использовать дельта-проверки любого из этих показателей для обнаружения такого образца, поскольку быстрые изменения любого из них являются обычными у госпитализированных пациентов, причем, частота ложноположительных результатов будет здесь неприемлемо высокой. Тем не менее, внутривенное загрязнение приводит к пропорциональному снижению всех этих показателей.
Следует также отметить, что выполнение дельта-проверок на MCHC имеет дополнительное преимущество для обнаружения неисправности анализатора, поскольку MCHC рассчитывается на основе трех параметров эритроцитов RBC, HB и MCV, которые измеряются непосредственно на большинстве гематологических анализаторов. Следовательно, проблемы в любом из этих измерений будут влиять на MCHC. Выбор пределов достоверности для дельта-проверок зависит от ряда факторов, в том числе от желаемого баланса чувствительности и специфичности и оцениваемой популяции пациентов. Статистический подход к дельта-проверкам может быть достигнут путем получения пар точек данных пациентов из репрезентативной популяции. Пределы, охватывающие желаемую долю населения (например, 95% или 99%), могут быть легко выбраны (Savage R., 2006).
Температура хранения
Гемоглобин, количество эритроцитов, количество лейкоцитов, средний корпускулярный гемоглобин остаются стабильными в течение по меньшей мере 24 часов при температуре 33 ° C. Гематокрит, средний корпускулярный объем и количество тромбоцитов стабильны в течение менее четырех часов при 33 ° C. Все вышеперечисленные параметры стабильны при 22 ° С и 4 ° С. Дифференциальная оценка HCT, MCV, PLT показала нестабильность в течение четырех часов при температуре 33 ° C.
Некоторые параметры, связанные с эритроцитами, такие как RBC, HB и MCHC, менее стабильны при хранении при 4 ° C, поскольку на них может повлиять первоначальное замораживание с последующим охлаждением Изменение HCT и MCHC, несомненно, является следствием изменения MCV, поскольку эти параметры частично получены из последнего показателя.
Гемолиз in vitro
Термин «гемолиз» происходит от латинского слова hemo (кровь) и лизиса (взломать) и означает разрушение клеток крови. Лаборанты обычно ограничивают значение понятия «гемолиз» эритроцитами (процесс, называемый эритролизом), которые составляют наибольший процент эритроцитов крови и игнорируют состояние других клеток крови. В связи с этим подходом методы оценки гемолиза зависят «исключительно» от измеренного количества свободного гемоглобина (fHB), выделившегося из разрушенных эритроцитов. Напротив, небольшое количество авторов описывают «гемолиз» как разрушение всех типов клеток крови, а именно панцитолиз и заявляют, что лейкоциты и тромбоциты также могут поддвергаться гемолизу. Стоит отметить, что лейкоциты могут способствовать повышению уровня калия в состоянии лизиса.
Гемолиз может происходить in vivo, при патологических состояниях или in vitro в связи с преаналитическими ошибками.
Гемолиз in vitro в преаналитической фазе является основной проблемой, с которой сталкиваются клинические лаборатории. Определяемый как разрыв мембраны эритроцита с экстравазацией гемоглобина и других внутриклеточных компонентов в окружающую плазму, гемолиз можно обнаружить визуально во время лабораторной оценки из-за изменения окраски плазмы от розового до красного после центрифугирования образца.
Гемолиз in vitro обычно возникает в результате неадекватного забора крови, включая такие факторы, как использование игл малого диаметра, попадание остатков спирта с кожи в образец, трудности с поиском венозного доступа, маленькие и хрупкие вены, которые легко травмируются, и попытки неудовлетворительной пункции. Кроме того, неправильное обращение с образцами, такое как недостаточное заполнение пробирки для сбора, приводящее к избытку антикоагулянта, сильное встряхивание образца, воздействие чрезмерно высоких или низких температур и центрифугирование на очень высокой скорости в течение длительного периода времени, также являются факторами, которые могут нарушить структурная целостность клеток крови (Lippi G., et.al., 2008).
Факторы, способствующие гемолизу in vitro вследствие неадекватного забора крови
Использование игл малого размера
Попадание остатков спирта с кожи в образец
Трудности с поиском венозного доступа
Маленькие и хрупкие вены, которые легко травмируются
Неоднократные попытки плохой пункции
Было показано, что с течением времени количество эритроцитов значительно снижается из-за гемолиза. Повышенная проницаемость клеток будет определяться увеличением MCV — индекса, отражающего набухание эритроцитов. Изменение HCT и MCHC явно является следствием изменения MCV, поскольку эти параметры частично получены из MCV (Buoro S., et al., 2016).
В работе G. de Longe et.al. (2018) образцы с высокой степенью гемолиза превышали спецификации качества для желаемой систематической ошибки, демонстрируя снижение эритроцитов (4,7%), гематокрита (6,6%), MCV (0,6%) и увеличение параметров: RDW (1,3%), MCH (1,5%), MCHC (2,5%) и количество тромбоцитов (36,7%). В то время как образцы с легкой степенью гемолиза имели умеренное увеличение MCH (0,6%), MCHC (0,7%) и количества тромбоцитов (1,4%). Авторами было замечено, что RCB имел погрешность -6,4% (от -22,8% до 10,0%), а HCT — погрешность -8,3% (от -25,7% до 9,2%), превышающую допустимые нормы ±1,7% для проб с высокой степенью гемолиза. Так, эти показатели могут быть занижены до 22,8% для эритроцитов и до 25,7% для HCT или завышены до 10,0% и 9,2% соответственно.
Стоит отметить, что принцип измерения MCV сильно различается в зависимости от используемого гематологического анализатора. с помощью метода импеданса образцы с высокой степенью гемолиза могут демонстрировать умеренное изменение MCV (увеличение на 0,6%) с последующим увеличением RDW на 1,3%, что представляет собой широкий разброс примерно в 12%, оценивая пределы согласия и их доверительные интервалы.
Гемолиз образца крови, взятого для CBC
Высокая степень гемолиза
Снижение RBC (4,7%), HCT (6,6%), MCV (0,6%)
Увеличение RDW (1,3%), MCH (1,5%), MCHC (2,5%)
Отсутствии изменений HB
Увеличение PLT (36,7%)
Низкая степень гемолиза
Увеличение MCH (0,6%), MCHC (0,7%), PLT (1,4%)
Сравнение образцов с разной степенью гемолиза показало снижение количества эритроцитов и гематокрита и увеличение средней концентрации корпускулярного гемоглобина и количества тромбоцитов в образцах с высокой степенью гемолиза. Согласно принятой клинической точке зрения, образцы с высокой степенью гемолиза превышают желаемую погрешность, демонстрируя снижение RBC, HCT и MCV, а также увеличение RDW, MCH, MCHC, PLT. Однако образцы с легкой степенью гемолиза показали лишь незначительное увеличение среднего корпускулярного гемоглобина, средней концентрации корпускулярного гемоглобина и количества тромбоцитов. (de Jonge G., et.al.,2018).
Выяснение интерференционных механизмов гемолиза необходимо для более точного решения проблемы гемолиза in vitro. Гемолизированные образцы влияют на результаты испытаний по нескольким механизмам, таким как: композиционные помехи (из-за разницы между внутриклеточной и внеклеточной концентрацией аналитов), помехи сигнала в инструментальных измерениях и химической помехи в аналитических реакциях. Эти интерференционные механизмы могут сосуществовать в различных сочетаниях. Отказ от результатов анализа гемолизированных образцов может привести к задержке в диагностике, что угрожает безопасности пациента, а запрос дополнительного образца увеличивает рабочую нагрузку лаборанта и стоимость исследования.
Вполне возможно, что клеточный дебрис и строма, образующиеся в результате распада эритроцитов, могут вызывать существенные аналитические помехи в подсчете тромбоцитов
М.О. Егорова
д-р мед. наук, проф. кафедры КЛД ГОУ ВО Российский национальный исследовательский медицинский университет имени Н.И. Пирогова Минздрава России, руководитель отдела развития технологий и обучения Компании «ОМБ»,
Т.П. Сапенко
канд. мед. наук, ведущий специалист отдела развития технологий и обучения Компании «ОМБ»,
Н.В. Патругина
специалист по продукции отдела развития технологий и обучения Компании «ОМБ»
В статье подробно рассмотрены факторы преаналитического этапа, оказывающие влияние на результат лабораторного исследования проб крови, о которых необходимо знать медицинским сестрам. К ним относятся: заполнение бланка-заявки, подготовка пациента к исследованиям, время суток и положение пациента при взятии проб, условия хранения и доставки пробы в лабораторию и многое другое. Представленный материал позволит учесть факторы преаналитического этапа и подготовить стандартные операционные процедуры взятия венозной крови, что повысит качество результатов лабораторных исследований. Клиническая лабораторная диагностика – постоянно развивающаяся область медицины, основная задача которой – получение объективных данных о состоянии здоровья пациента.
Клинические решения основаны на результатах лабораторных исследований, что определяет ответственность лаборатории в соблюдении технологии аналитического этапа. Значительную часть преаналитического этапа выполняют вне лаборатории, однако ошибки, возникающие в этот период, ведут к искажению результатов лабораторного исследования. Выбор необходимых для обследования пациента лабораторных тестов, соблюдение процедуры взятия крови, идентификации пациента и образца зависит от врача-клинициста и процедурной медицинской сестры. Стандартизация процедур преаналитического этапа – задача, решаемая совместно врачом-клиницистом, медицинской сестрой процедурного кабинета, лабораторией и поставщиком медицинской продукции для обеспечения преаналитического и аналитического этапов лабораторного исследования.
На преаналитический этап приходится не менее 50% общего числа лабораторных ошибок [2], которые могут привести к неправильной постановке диагноза и последующему назначению неадекватной терапии. Ценой такой ошибки может стать жизнь пациента.
Одной из основных задач преаналитического этапа является адекватный отбор проб крови и обеспечение стабильности (сохранности) образца.
Практика показывает, что именно стандартизация преаналитического этапа позволяет сократить ошибки диагностики. Важным условием стандартизации преаналитического этапа служит не только соблюдение протокола, но и использование сертифицированных и одноразовых расходных материалов для взятия крови.
Правила заполнения бланка направления
Первый шаг при инициации лабораторного обследования пациента – формирование направления. Бланк-направление в лабораторию для проведения исследований должен содержать информацию о пациенте (Ф. И. О., пол, возраст, домашний адрес, номер страхового полиса), об источнике получения крови (тип образца: венозная, артериальная, капиллярная). Необходимо также указать дату и время взятия крови и, конечно, перечень необходимых исследований.
Источник получения крови (как и возраст) определяет соответствующие референтные значения. Например, существуют различия между концентрацией глюкозы капиллярной и венозной крови. Капиллярная кровь – среда, содержащая интерстициальную жидкость и артериальную кровь, поэтому концентрация глюкозы в капиллярной крови (в среднем 5,4 ммоль/л) выше, чем в венозной (в среднем 4,1 ммоль/л).
Маркировка времени взятия крови на бланке позволяет оценить сохранность компонентов пробы крови до исследования. Наряду с традиционным периодом доставки крови, в течение часа после получения пробы, есть ряд исследований, которые необходимо выполнить в течение 10 мин после взятия крови. Для подобных исследований бланк-направление в лабораторию может иметь специальную пометку и указание способа доставки (вакуумная почта, например) и условий сохранности содержимого пробы. Например, пробы для исследования гемостаза, наиболее чувствительные к условиям хранения,
должна доставлять в лабораторию медицинская сестра клинического отделения. Дополнительно можно предусмотреть предварительное центрифугирование пробы (в случае использования пробирок с разделительным гелем). Это обеспечит последующую сохранность содержимого сыворотки или плазмы до 48 ч при необходимости длительной транспортировки.
Последний момент – перечень необходимых исследований.
Врач, направивший больного на обследование с рукописным бланком, может упустить необходимые и желаемые исследования. Использование лабораторной информационной системы упрощает заполнение бланка, позволяя сделать выбор из списка. Кроме того, по результатам считывания штрихкода в направлении можно получить всю информацию, заключенную в бланке, как о пациенте, так и о направившем его враче.
Факторы, влияющие на результат анализа
В утреннее и вечернее время содержание многих компонентов крови отличается. Суточные биоритмы определяют концентрацию и активность биологических процессов и, например, максимальную экскрецию с мочой фосфатов, катехоламинов, кортизола, альдостерона отмечают в вечерние часы, а натрия – в утренние. Содержание в сыворотке крови гормонов АКТГ, кортизола, адреналина, норадреналина, ренина максимально в утренние часы, тогда как тиреотропного, соматотропного гормона, железа, калия – в вечерние часы [7].
Взятие крови для исследования в утренние часы в одно и тоже время важно и с точки зрения последующего сравнения результатов исследования в динамике. Оценить, что послужило причиной изменения содержания компонента в крови – суточные колебания или влияние терапии, – сложно, если нет развернутой информации о времени исследования, условиях взятия крови, лекарственной терапии, составе пи-
тания, предшествующей физической нагрузке и других факторах. Поэтому по умолчанию кровь берут у пациента утром натощак [7], до любых физиотерапевтических процедур, рентгенодиагностики и УЗИ. Необходимо исключить прием алкоголя и курение за 24 ч до времени сдачи анализа. Курение и прием кофе влияют на результаты исследования многих компонентов (например, С-реактивный белок, билирубин и многие др.). [7, 9]
Физические нагрузки изменяют значения некоторых лабораторных показателей в крови: в первую очередь концентрацию лактата, креатинина, белков и активность ферментов.
После прекращения физической нагрузки длительно, в течение 24 ч и более, сохраняется повышенная активность креатинкиназы и ЛДГ. [9]
Лабораторное обследование выполняют, как правило, неоднократно. Врачу-клиницисту важно получить и увидеть эффект терапии в динамике. Поэтому необходимо выполнять
исследование каждый раз в одно и то же время (учитывая суточные колебания) и получать кровь пациента в одной и той же позиции (в положении лежа или сидя).
От положения тела зависит интенсивность диффузии жидкости в тканевое пространство. В положении сидя концентрация белка, кальция, гормонов, количество клеток в образце будет выше. В некоторых случаях отличия при исследовании проб одного и того же пациента, взятых при разных положениях тела, будут значительными (табл. 1)[3]. Чаще всего горизонтальное положение тела при венепункции предпочтительнее, т. к. при вертикальной позиции происходит отток жидкости из сосудов, изменяя концентрацию аналитов на 5–9% и более.[8]
Таблица 1
Изменение некоторых биохимических аналитов при смене положения пациента: из горизонтального в вертикальное
| Параметр | Увеличение, % |
| Гемоглобин | 5 |
| Лейкоциты | 7 |
| Гематокрит | 13 |
| Эритроциты | 15 |
| Кальций | 5 |
| АСТ активность | 6 |
| Tироксин | 7 |
| IgG | 7 |
| IgA | 8 |
| IgM | 6 |
| Белок | 9 |
| Tриглицериды | 9 |
| Холестерин ЛПВП | 10 |
| Aльдостерон | 15 |
| Эпинефрин | 48 |
| Ренин | 60 |
Фактором, существенно изменяющим или затрудняющим лабораторное исследование образца, служит липемия (хилез), возникающий физиологически в течение 12 ч после приема пищи. Липемия определяется как мутность, видимая невооруженным глазом, в жидкой надосадочной части исследуемых образцов; в крови возникает мутность за счет наличия хиломикронов, носителей экзогенных (пищевых) липидов. [5]
Традиционно используемое понятие «натощак» означает, что последний прием пищи был не позднее 12 ч до времени взятия крови. Отдельные пациенты, например страдающие сахарным диабетом, не могут выдержать столь длительный перерыв в еде. Минимально короткий возможный перерыв (при приеме нежирной пищи) составляет 4 ч. В таком случае можно полагать, что хиломикроны, поступающие из кишечника в кровь, будут уже метаболизированы.
Причин изменения состава образца крови, не связанных с патологическими состояниями пациента, может быть несколько. Нарушение времени последнего приема пищи, поглаживание руки пациента, наложение жгута на период более 1 мин, длительная «работа кулаком» для пациента с фиксированной жгутом веной приводят к гемолизу и гиперкалемии.
Спектральная интерференция (влияние на получаемый результат), вызываемая липемией, в корне отличается от интерференции, возникающей при гемолизе и иктеричности.
Липемия создает помехи за счет присутствия в образце жиросодержащих компонентов, которые, рассеивая свет, образуют молочный или мутный вид образца сыворотки/плазмы крови. Степень рассеяния света зависит от количества, размера и показателя преломления взвешенных частиц (хиломикроны и липопротеиды очень низкой плотности), которые образуют мутность и создают белую окраску сыворотки, называемую хилезом или липемией (рис. 1b).
Гемолиз
Одной из проблем, препятствующей исследованию образца, является гемолиз – нарушение целостности эритроцитов и последующее увеличение во внеклеточном пространстве концентрации внутриклеточных компонентов. Внутриклеточная концентрация некоторых клеточных компонентов в 10 раз выше их внеклеточной концентрации. Гемолиз, обнаруживаемый в плазме/сыворотке крови, служит причиной увеличения концентрации таких аналитов, как калий, лактатдегидрогеназа, аспартатаминотрансфераза, магний.
Спектральная интерференция гемолиза (рис. 1c) определяется выходом внутриэритроцитарного гемоглобина в сыворотку/плазму крови. Гемоглобин отличается высоким поглощением света при характерной для него длине волны.
Отмеченное увеличение или уменьшение результатов при гемолизе зависит от метода и концентрации аналита.
Наличие гемолиза распознают по появлению различной выраженности красноватого окрашивания плазмы или сыворотки крови после центрифугирования. Основные причины гемолиза указаны в табл. 2.
Кроме хилеза и гемолиза, наиболее частую интерференцию результатов исследования может повлечь повышенный уровень билирубина в крови пациента (гипербилирубинемия), обуславливающий иктеричность сыворотки (рис. 2).
Гемолиз в пробе (за исключением исследований, не чувствительных к гемолизу) служит критерием для отказа в принятии лабораторией биоматериала на исследования (ГОСТ Р 53079.4-2008. Технологии
лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа). [6]
Процедура взятия крови зависит не только от опыта и навыка процедурной сестры, но и от используемого расходного материала для венепункции и получения образца. Пациенты в отделении химиотерапии, пожилые больные требуют специальных приспособлений для комфортной венепункции, таких как игла-бабочка и иглы большего диаметра.
Условия, в которых будет получен адекватный результат, следует оговорить и сообщить пациенту, указав в направлении.
Так, чтобы исключить возможность ложноположительных результатов при исследовании PSA и его растворимой фракции, взятие крови следует проводить не ранее чем через 5 сут после таких манипуляций, как пальцевое ректальное исследование, массаж простаты, трансректальное ультразвуковое исследование (когда датчик вводят в прямую кишку) и после любых других механических воздействий на предстательную железу (клизма, тепловые процедуры и т. п.). Рекомендуют также избегать эякуляции за 2–3 дня до исследования, езды на велосипеде или на лошади, а также употребления алкоголя. [1]
Нельзя забывать, что принимаемые лекарства могут существенно менять состав исследуемого образца. Например, прием единичной дозы железосодержащего препарата накануне исследования может повысить концентрацию железа в исследуемой сыворотке пациента на 300–500 мкг/100 мл, и этот эффект часто маскирует дефицит железа. [4]
В таблице 3 отражены ограничения для некоторых лабораторных исследований. Каждый раз, внедряя новый лабораторный тест, лаборатория изучает инструкцию и сообщает условия взятия биоматериала врачам-клиницистам, медицинским сестрам, в направлении или памятке для пациента.
(Продолжение материала в мартовском номере издания. Следите за новостями!)
Список литературы
1. Говоров А.В. ПСА в деталях // Урология сегодня. 2011. № 6. С. 2–4.
2. Гудер В.Г., Нарайанан С., Виссер Г., Цавта Б. Проба: от пациента до лаборатории / Пер. с англ. Меньшикова В.В. Мюнхен: GIT VERLAG GmbH. 2003. 105 с.
3. Егорова М.О. Биохимическое обследование в клинической практике. М.: Практическая медицина. 2008. 144 с.
4. Тиц Н. Клиническое руководство по лабораторным тестам / Пер. с англ. под редакцией Меньшикова В.В. М.: Юнимед-пресс. 2003. 570 с.
5. Tомас Л., Гиньска E., Митчел C.A., Мэй К. Сывороточные индексы: сокращение ошибок в лабораторной медицине. Результат, которому можно доверять. ООО «РОШ Диагностика Рус». 2013. 12 с.
6. ГОСТ Р 53079.4-2008. Технологии лабораторные клинические. Обеспечение качества клинических лабораторных исследований. Часть 4. Правила ведения преаналитического этапа. 2009.
7. Справочное пособие. Обеспечение качества лабораторных исследований. Преаналитический этап / Под. ред. В.В. Меньшикова. М.: ЛАБИНФОРМ, 1999. 316 с.
8. Blick K.E., Liles S.M. Principles of Clinical Chemistry. NY.: Wiley and Sons. 1985. Р. 697.
9. McCall E., Tankersley M. Phlebotomy essentials. 3-rd edition. Lippincott Williams & Wilkins. 2003. Р. 306.
Рис. 1. Вид сыворотки крови после
центрифугирования:
а – сыворотка, пригодная для исследования;
b – образец хилезной сыворотки;
c – образец гемолизной сыворотки

Рис. 2. Вид пробы с различными компонентами
интерференции:
a – хилез;
b – лаковый гемолиз;
c – гипербилирубинемия 100 мкмоль/л;
d – билирубинемия 9 мкмоль/л;
e – билирубинемия 3 мкмоль/л
а b c а b c d e
Таблица 3
ПРИМЕРЫ ОГРАНИЧЕНИЙ (ИЛИ ИХ ОТСУТСТВИЯ) ДЛЯ НЕКОТОРЫХ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИЙ
| Наименование теста |
Предпочтительное время получения образца |
Ограничения по приему пищи |
Примечания |
|
Липидный спектр (общий холестерин, холестерин липопротеидов, триглицериды) |
По назначению врача |
Натощак | — |
| Гормональный профиль |
Утренние часы: 7.00–9.00 |
Натощак |
До приема лекарственных препаратов |
| Коагулограмма |
По назначению врача |
Натощак |
В соответствии с фармакодинамикой лекарственного препарата |
|
Ионы (железо, калий, натрий) |
Утренние часы: 7.00–9.00 |
Натощак | — |
|
Гликозилированный гемоглобин HbA1c, гомоцистеин |
В любое время по назначению врача |
Нет ограничений по времени приема пищи до исследования |
— |
Актуальность
Часто у лечащего врача возникают претензии к лабораторным анализам, т. е. происходит не совпадение клинической картины с лабораторными показателями. Нарушение преаналитики является одной из самых частых причин этой проблемы. Данная статья поможет разобраться с этой нелепой, но весьма серьезной задачей.
Что такое преаналитика? Преаналитика – это все процедуры, выполняемые до начала проведения лабораторных исследований, которые непосредственно влияют на результат лабораторного анализа.
Оптимально проведенная преаналитическая подготовка является основным условием точной и полной лабораторной диагностики.
Зачем нужно врачам знать преаналитику? При нарушении преаналитического этапа врачи собственноручно готовят предпосылки для заведомо ложных результатов лабораторного анализа.
Статистика
Затраты времени на этапах лабораторного исследования:
Преаналитическии этап вне лаборатории – 20,20%
Преаналитическии этап в лаборатории – 37,10%
Аналитическии этап – 25,10%
Постаналитическии этап – 13,60%
Отправка результатов – 4%
Анализ ошибок показывает, что около 40% ошибок совершается на преаналитическом этапе при выполнении исследований в плановом порядке и около 60% ошибок происходит на преаналитическом этапе при неотложных анализах. (M.Plebani, P.Carraro, 1997).
Из чего состоит преналитическии этап вне лаборатории?
— Назначение анализов
— Подготовка пациента (психологическая и физическая)
— Заполнение направления.
— Взятие биоматериала.
— Хранение и доставка биоматериала.
На каждом из выше указанных составных может быть допущена ошибка.
Общие правила при подготовке к исследованию крови:
1. Кровь сдается в утренние часы натощак (или в дневные и вечерние часы, спустя 4-5 часов после последнего приема пищи). За 1-2 дня до исследования исключить из рациона продукты с высоким содержанием жиров.
2. Показатели крови могут существенно меняться в течение дня, поэтому рекомендуется все анализы сдавать в утренние часы.
3. Накануне исследования (в течение 24 часов) исключить алкоголь, интенсивные физические нагрузки, прием лекарственных препаратов (по согласованию с врачом).
4. За 1-2 часа до сдачи крови воздержаться от курения, не употреблять сок, чай, кофе, можно пить негазированную воду. Исключить физическое напряжение (бег, быстрый подъем по лестнице), эмоциональное возбуждение. За 15 минут до сдачи крови рекомендуется отдохнуть, успокоиться.
5. Не следует сдавать кровь для лабораторного исследования сразу после физиотерапевтических процедур, инструментального обследования, рентгенологического и ультразвукового исследований, массажа и других медицинских процедур.
6. При контроле лабораторных показателей в динамике рекомендуется проводить повторные исследования в одинаковых условиях – в одной лаборатории, сдавать кровь в одинаковое время суток и пр.
7. Кровь для исследований нужно сдавать до начала приема лекарственных препаратов или не ранее, чем через 10 — 14 дней после их отмены. Для оценки контроля эффективности лечения любыми препаратами нужно проводить исследование спустя 7 – 14 дней после последнего приема препарата. Если Вы принимаете лекарства, обязательно предупредите об этом лечащего врача.
Общие правила применимы ко всем анализам, но для некоторых исследований требуется специальная подготовка и дополнительные ограничения.
Влияние некоторых факторов на результат анализов.
Психический стресс
Степень влияния психического стресса (страх перед взятием крови, предоперационный стресс и т.д.) на лабораторные результаты часто недооценивается. Между тем, под его влиянием может наблюдаться увеличение секреции гормонов (альдостерона, ангиотензина, катехоламинов, кортизола, пролактина, ренина, соматотропина, ТСГ, вазопрессина) и повышение концентрации альбумина, фибриногена, глюкозы, инсулина, лактата и холестерина.
Наложение жгута
Что происходит, когда жгут накладывается на весь период времени при взятии пробы? При использовании давления ниже уровня систолического, внутри капилляров поддерживается эффективное фильтрационное давление. Как следствие, жидкость и низкомолекулярные соединения перемещаются из внутрисосудистого пространства в интерстициальное. Макромолекулы, вещества, связанные с белками и клетки крови не проникают через стенку капилляров, таким образом, их концентрация заметно возрастает, тогда как концентрации низкомолекулярных веществ не изменяются.
Длительность наложения жгута и изменения уровней исследуемых параметров
Сравнение: через 1 мин. через 3 мин.
Параметры Отклонение в %
Билирубин +8
Холестерин +5
Креатинин -9
Креатинкиназа -4
Железо +7
Глюкоза -9
γ-Глютамилтрансфераза -10
Калий +5
Положение тела
Изменение положения тела – из горизонтального в вертикальное – приводит к увеличению уровня ряда показателей.
Параметры Увеличение в %
Гематокрит 13
Эритроциты 15
Холестерин высокой плотности 10
Альдостерон 15
Ренин 60
Взятие пробы из катетера
Если пробы берут из венозных или артериальных инфузионных катетеров, канюлю следует промыть изотоническим солевым раствором в объеме, соизмеримом с объемом катетера. Прежде чем взять пробу, выбросить первые 5 мл крови, полученной из катетера. Взятиепроб для исследований свертывающей системы из катетеров, обработанных гепарином, неприемлемо. Для гепарин-зависимых методов (тромбиновое время, АЧТВ) рекомендуется
предварительно отбросить объем крови, вдвое превышающий объем катетера; первая порция взятой затем крови может быть использована для выполнения исследований, не относящихся к системе гемостаза; последующая порция цитратной крови может использоваться только для определения нечувствительных к присутствию гепарина аналитов: протромбинового времени, рептилазного времени, фибриногена по Clauss, АТ III, мономеров фибрина. Важно, чтобы перед взятием крови в пробирку с раствором цитрата натрия не было длительной паузы, в течение которой кровь в катетере может «застаиваться».
Высота над уровнем моря
Содержание некоторых компонентов крови подвержено значительным изменениям в зависимости от высоты над уровнем моря. С увеличением высоты значительное повышение наблюдается в отношении, например реактивного белка (до 65% на высоте 3600 м), гематокрита и гемоглобина (до 8% на высоте 1400 м) и мочевой кислоты. Адаптация к высоте занимает недели, а возвращение к значениям на уровне моря происходит в течение нескольких дней. Значительное снижение величин с ростом высоты над уровнем моря обнаружено в отношении мочевого креатинина, клиренса креатинина, эстриола (до 50% на высоте 4200 м), осмоляльности сыворотки, ренина плазмы и трансферрина сыворотки.
1 Мошкин А., Долгов В. Обеспечение качества в клинической лабораторной диагностике.. — М.: 2004. – С. 26-43.
2 Преаналитический этап. Пробоподготовка. West Medica
3 Преаналитика: практические советы и методы. SARSTEDT AG & Co.
Түйін: преаналитикалық кезенде көптеген факторлар зертханалық зертудің нәтижесіне әсер ететің зертхана дәрігерлері жақсы түсінеді. Ал клиникалық дәрігердің көбісі бұл жағдайдың маңызың ескермейді. Осы салалардың әсерінен зертханалық зертудің нәтижесін дәрігерлер дұрыс талдамауына және дұрыс ем шара жасамауына алып келеді.
Resume: physicians of Clinical Laboratory Diagnostics had recognized that, in the preanalytical phase, many factors can affect to the results of laboratory tests. Most of physicians don’t know of their influence. Ignorance of this factors may lead to misinterpretation of the result and take on a patient the wrong action.
АННОТАЦИЯ
Процесс клинического лабораторного исследования включает три этапа: преаналитический, аналитический и постаналитический. Несмотря на то, что частота аналитических ошибок в клинических лабораториях существенно снизилась за счет автоматизации и современных технологий, ошибки, связанные с преаналитическим и постаналитическим этапами остаются значительными и требуют внимания специалистов по лабораторной медицине к тому, что происходит за пределами лаборатории. В интересах пациентов необходимо рассматривать любые прямые и косвенные негативные последствия, связанные с лабораторными исследованиями, независимо от того, на каком этапе возникает ошибка.
Введение. Клиническая безопасность пациента определяется правильной и своевременной диагностикой патологии и применением адекватных лечебных мероприятий (при минимальных побочных действиях) с целью достижения благополучного исхода случая заболевания [1] .
Согласно литературным данным на основе результатов лабораторных исследований принимаются до 60-70% клинических решений относительно диагноза заболевания и тактики лечения [2-4].
Как отмечает в своей публикации Меньшиков В.В., «процесс клинического лабораторного исследования – от решения врача назначить анализ до получения им результата анализа – проходит три этапа, в которых соответствующие процедуры выполняет несколько участников. Задача всех участников процесса заключается в том, чтобы как можно меньше изменить состав взятого у пациента образца и в результате анализа отразить с наибольшей точностью те его содержание и свойства, которыми обладает этот материал в организме пациента, и правильно интерпретировать результат, с тем, чтобы получить достоверную лабораторную информацию.
На всех этапах лабораторного процесса могут возникнуть отклонения, приводящие к ошибочному итогу – не вполне достоверной информации».
Автор демонстрирует следующий рисунок этапов клинического лабораторного исследования: до лабораторный, лабораторный и после лабораторный (рисунок 1)
В литературе встречаются и другие названия этапов лабораторного процесса: преаналитический, аналитический и постаналитический.
Следовательно, ошибки, связанные с проведением лабораторных исследований могут быть обусловлены многими причинами на различных этапах проведения: назначением лабораторного теста, не соответствующего клинической задаче; нарушением условий взятия образца биоматериала, его хранения, предварительной обработки и транспортировки; недостаточной квалификацией оператора; недостаточным учетом влияний биологической, ятрогенной, аналитической вариации при оценке результата исследования; неудовлетворительной нозологической интерпретацией результата исследования; задержкой передачи информации о критических изменениях лабораторных показателей и др. Целый комплекс факторов, которые могут оказывать существенное влияние на качество результатов анализов, находится в компетенции врачей-клиницистов и среднего медицинского персонала. Изучение этих факторов будет способствовать обеспечению качества результатов лабораторных исследований.
Целью данного обзора является изучение типов и частоты ошибок в лабораторной медицине на основе анализа международной научной литературы.
Материалы и методы. Были изучены результаты научных исследований в области лабораторной медицины за последние 10 лет. Поиск научных публикаций проводился в базах данных PubMed, Oxford University Press, Google Scholar.
Результаты. Проблема ошибок в клинической лаборатории в последнее время привлекает большое внимание, так как играет ключевую роль для медицинских услуг и может создавать серьезный риск, влияющий на жизнь пациента. Частота лабораторных ошибок значительно варьируется в зависимости от процедур диагностики и этапов всего процесса тестирования [5].
Как отмечают авторы, «частота аналитических ошибок в клинических лабораториях существенно снизилась за последние годы в результате активного движения за безопасность пациентов и внедрения передовых технологий в проведение лабо-

раторных тестов. Однако, по сравнению с медицинскими ошибками других типов, ошибкам в лабораторной медицине уделяется мало внимания. Ошибки в лабораторной медицине трудноопределимы, поскольку их трудно идентифицировать и, даже после обнаружения, понять их причину сложнее, чем в случае медицинских ошибок другого типа. Если сравнивать с неблагоприятными исходами, вызванными хирургическим и другими, зачастую совершенно очевидными, ошибками, совершенными в ходе лечения, лабораторные ошибки имеют тенденцию быть менее явными, указать время и место их совершения непросто» [6].
Традиционно процесс клинического лабораторного исследования подразделяется на 3 этапа:
- — преаналитический этап (назначение определенного исследования, взятие образца биоматериала, его предварительная обработка, хранение и транспортировка к месту проведения собственно анализа);
- — аналитический этап (идентификация образца биоматериала, необходимая обработка для получения аналитической пробы, применение аналитической технологии с использованием соответствующих реагентов и оборудования, получение описательного или количественного результата исследования);
- — постаналитический этап (оценка аналитической, биологической, клинической достоверности результата исследования, его нозологическая интерпретация, доставка результата назначившему исследование персоналу, хранение образца и результатов исследования в условиях и в течение сроков, установленных применительно к данному виду исследования и клинической задаче).
Большинство ошибок происходит на пре- и постаналитическом этапах (таблицы 1,2) [7]. Что касается аналитического этапа, то Lippi и коллеги опубликовали, что общий коэффициент ошибок в процессе тестирования широко варьируется от 0,1% до 3,0% [8]. В исследованиях, проведенных Plebani M., Carraro P., уровень лабораторных ошибок за 10 лет снизился с 0,47% в 1977 году до 0,33% в 2007 году [9-10]. Согласно другим литературным данным (Belk and Sunderman, 1947; Witte, 1997) за период с 1947 по 1997 гг. частота ошибок аналитического этапа снизилась с 162116 на миллион лабораторных тестов (part per million, ppm) до 447 ppm [11-12].
Это произошло благодаря автоматизации, усовершенствованию лабораторных технологий, стандартизации анализа, использованию тщательно разработанных правил внутреннего контроля и эффективных схем обеспечения качества, а также благодаря повышению уровня подготовки персонала.
Однако неудовлетворительное качество остается при выполнении и оценке стандартных клинических биохимических и коагуляционных тестов, гематологических и молекулярно-биологических тестов. В частности, относительно высокая частота аналитических ошибок и связанных с ними неблагоприятных клинических последствий была задокументирована при выполнении иммунохимических исследований.
Таблица 1. Частота встречаемости и типы ошибок на различных этапах аналитического процесса (Mario Plebani, 2007)
|
Типы ошибок |
1996 год |
2000 год |
||
|
ppm |
% |
ppm |
% |
|
|
Общее количество ошибок |
4667 |
100 |
3092 |
100 |
|
Преаналитических |
3186 |
68,3 |
1914 |
61,9 |
|
Аналитических |
617 |
13,2 |
463 |
15,0 |
|
Постаналитических |
864 |
18,5 |
715 |
23,1 |
Таблица 2. Типы ошибок и их частота на различных этапах всего аналитического процесса (Mario Plebani, 2010).
|
Этап общего аналитического процесса |
Тип ошибки |
Относительная частота (%) |
|
Пре-преаналитический |
Ошибка при выборе тестов Ошибка при составлении заявки Неверная идентификация пациентов/ образцов Использование образцов, собранных из канала инфузии Ошибка при сборе образцов (гемолиз, свертывание, недостаточный объем, и т.д.) Использование неподходящей емкости Обращение, хранение и транспортировка |
46,0-68,2% |
|
Преаналитический |
Неправильная сортировка и пересылка образцов Проливание образцов Ошибка при аликвотировании, пипетировании и маркировке Ошибка при центрифугировании (неверное время и/или скорость) |
3,0-5,3% |
|
Аналитический |
Неисправность оборудования Анализ не того образца Интерференция (эндогенная и экзогенная) Невыявленная ошибка контроля качества |
7,0-13,0% |
|
Постаналитический |
Ошибочная валидация данных анализа Несообщение результатов/ передача результатов не тому адресату Слишком большое общее время анализа Неправильный ввод данных и ошибка при записи данных от руки Несообщение/задержка в сообщении о критических значениях |
12,5-20,0% |
|
Пост- постаналитический |
Запоздалая реакция/Отсутствие реакции на лабораторный отчет Неверная интерпретация Неподходящий/неадекватный план диспансерного наблюдения Неназначение необходимой консультации |
25,0-45,5% |
В исследовании, проведенном Laposata M., Dighe A. [13], было установлено, что неправильная интерпретация диагностических и лабораторных тестов врачом, а также неинформирование амбулаторных больных о клинически значимых аномальных результатах, являются довольно широко распространенным явлением, примерно один случай на каждые 14 тестов. Примеры включают пациентов, которых не проинформировали о высоком уровне общего холестерина (8,2 ммоль/л, 318 мг/ дл), низком гематокрите (28,6%) и низком уровне калия (2,6 ммоль/л). Общее количество случаев, когда пациенту не была передана информация или факт передачи информации не был задокументирован, составило 7,1%, а диапазон таких случаев в разных учреждениях от 0% до 26%. Такая ситуация противоречит принципу «солидарной ответственности» и «совместного принятия решения», в рамках которых врач предоставляет пациенту и его семье всю клиническую информацию, включая результаты лабораторных исследований.
Вероятность неблагоприятных последствий лабораторных ошибок и назначения неадекватного лечения варьирует от 2,7% до 12%, но большая доля лабораторных ошибок (от 24,4% до 30%) отвечает за возникновение дополнительных проблем, не сказывающихся прямо на здоровье пациента. В исследованиях сообщается, что ошибки приводили к неадекватному помещению пациентов в отделение интенсивной терапии, ненужному переливанию крови, неверному изменению терапии гепарином и дигоксином. Влияние лабораторных ошибок на дальнейший клинический путь пациента – речь идет о дополнительных ненужных исследованиях (лабораторных, рентгенографических, томографических и т.п.), более инвазивных методах анализа, дополнительных консультациях – гораздо существеннее и, хотя не обязательно причиняет вред, однако доставляет лишнее беспокойство и ведет к дополнительным расходам, как для пациента, так и для системы здравоохранения [14].
Интерес представляют результаты исследования, проведенного в Республике Башкортостан [15]. Данные были собранны из 37 лабораторий медицинских организаций г.Уфы и Республики Башкортостан. Проводился опрос специалистов клинико-диагностических лабораторий государственных медицинских организаций и коммерческих лабораторий, включая заведующих (n=37), биологов (n=351), врачей КДЛ (n=112) по разработанной анкете, которая включала в себя 30 вопросов, касающихся организации работы на преана- литическом этапе лабораторного процесса. Исследования показали, что одной из самых распространенных ошибок на данном этапе является необоснованное назначение лабораторного обследования.
По мнению ряда авторов, на преана- литической фазе происходит большинство лабораторных ошибок [16-20]. В докладе Бонини и его коллег было установлено, что в лаборатории преобладали преданалити- ческие ошибки, варьирующиеся от 31,6% до 75% [21].
В 2008-2009 годах Chawla R. с соавторами определили, что для стационарных больных уровень преаналитической ошибки составил 1,9% (наибольшую частоту составил гемолиз образца – 1,1%), для амбулаторных больных частота ошибок составляла 1,2% (переменная с наивысшей частотой была необоснованность тестирования) [22]. Специалистами было выявлено четырнадцать различных причин преданалитической ошибки, наиболее распространенными из которых были ошибки при заполнении пробирки и идентификации пациента [23- 26].
Заключение. Согласно отчету исследователей из Медицинской школы Университета Джона Хопкинса в Балтиморе, медицинская ошибка является третьей по значимости причиной смерти в США [27]. Безопасность пациентов остается проблемой во многих областях здравоохранения, и лабораторная медицина может стать лидером в снижении ошибок [28].
Содействие эффективному контролю качества и постоянному совершенствованию всего процесса тестирования, включая пре- и постаналитические фазы, является необходимым условием для эффективного лабораторного обслуживания. Медицинские ошибки больше нельзя рассматривать как неизбежные, необходимо их активно оптимизировать и предотвращать [29-30].
СПИСОК ЛИТЕРАТУРЫ
- Меньшиков В.В. Клиническая безопасность пациента и достоверность лабораторной информации (лекция) // Клиническая лабораторная диагностика. -2013. -№6.
- Jordan B., Mitchell C., Anderson A., Farkas N., Batrla R. The Clinical and Health Economic Value of Clinical Laboratory Diagnostics // EJIFCC.-2015.-26(1). -Р.47–62.
- Frank H. Wians. Clinical Laboratory Tests: Which, Why, and What Do The Results Mean? // Laboratory Medicine.-2009.-Volume 40.-Issue 2. -P.105–113.
- Бражникова О.В., Гавеля Н.В., Майкова И.Д. Типичные ошибки на преаналити- ческом этапе проведения лабораторных исследований // Педиатрия. Приложение к журналу Consilium Medicum. -2017. -№4.
- Eng. Wafa’ Al-faraeh, Eng. Mohamed F. Ababeneh. The detection and prevention of errors in Clinical laboratory //International Journal of Scientific and Research Publications.- 2018.-Volume 8, Issue 11.-P.480-486.
- Mario Plebani. Выявление и предотвращение ошибок в лабораторной медицине// Annals of Clinical Biochemistry. -№ 47. -2010.-С. 101-110.
- Plebani M. Laboratory errors: How to improve pre- and post-analytical phases? // Biochem Med. -2007; 17:5-9.
- Lippi G., Plebani M., Šimundić A.M. Quality in laboratory diagnostics: From theory to practice //Biochem Med. -2010; 20:126-130.
- Plebani M., Carraro P. Mistakes in a stat laboratory: Types and frequency//Clin Chem. -1997; 43:1348-1351.
- Carraro P., Plebani M. Errors in a stat laboratory: Types and frequencies 10 years later //Clin Chem. -2007; 53:1338-1342.
- Belk WP, Sunderman FW. A survey of the accuracy of chemical analyses in clinical laboratories// Am J Clin Pathol 1947; 17:853-61.
- Witte VanNess S.A., Angstadt D.S., Pennell B.J. Errors, mistakes, blunders, outliers, or unacceptable results: how many? Clin Chem.-1997; 43:1352-6.
- Laposata M., Dighe A. ‘Pre-pre’ and ‘post-post’ analytic error: high incidence patient safety hazards involving the clinical laboratory //Clin Chem Lab Med.-2007; 45:712–9.
- Plebani M., Piva E. Notification of critical values//Biochem Med. -2010; 20:173-178.
- Аминев Р.А. Билалов Ф. С. Ошибки врача при выборе лабораторного исследования на преаналитическом этапе //Российская академия медицинских наук. Бюллетень Национального научно-исследовательского института общественного здоровья. – 2013. – №. 1. – С. 63-66.
- Fauzia Sadiq and all. Frequency of Errors in Clinical Laboratory Practice//Iranian Journal of Pathology.-2014.-№ 9 (1).-Р.45- 49.
- Sushma B.J., Shrikant C. Study on “Pre-analytical Errors in a Clinical Biochemistry Laboratory”: The Hidden Flaws in Total Testing //Biochem Anal Biochem 8:374.-2019. doi: 10.35248/2161-1009.19.8.374.
- Najat D. Prevalence of Pre-Analytical Errors in Clinical Chemistry Diagnostic Labs in Sulaimani City of Iraqi Kurdistan // PLoS One. -2017; 12(1):e0170211.
- Da Rin G. Pre-analytical workstations: A tool for reducing laboratory errors// Clin Chim Acta. — 2009; 404:68-74.
- Simundic A.M., Topic E., Nikolac N., et al. Hemolysis detection and management of hemolyzed specimens // Biochem Med. -2010;20:154-159.
- Bonini P., Plebani M., Ceriotti F., et al. Errors in laboratory medicine// Clin Chem. -2002; 48:691-698.
- Chawla R., Goswami B., Tayal D., et al. Identification of the types of preanalytical errors in the clinical chemistry laboratory: 1-year study at G.B. Pant Hospital //LabMedicine. — 2010; 41:89-92.
- Bates D.W., Gawande A.A. Improving safety with information technology //N Engl J Med. -2003; 348:2526-2534.
- Plebani M., Bonini P. Wrong biochemistry results. Interdepartmental cooperation may help avoid errors in medical laboratories //BMJ. -2002; 324:423-424.
- Lippi G., Guidi G.C. Risk management in the preanalytical phase of laboratory testing //Clin Chem Lab Med. -2007; 45:720-727.
- Lippi G., Chiozza L., Mattiuzzi C., Plebani M. Patient and Sample Identification. Out of the Maze? //Journal of Medical Biochemistry.-2017. -№36 (2).-Р.107-112.
- Makary M.A., Daniel M. Medical error-the third leading cause of death in the us // BMJ.-2016; 353:i2139.
- Bonini P., Plebani M., Ceriotti F., Rubboli F. Errors in laboratory medicine. Clin Chem.-2002; 48:691-8.
- Julie A. Hammerling, A Review of Medical Errors in Laboratory Diagnostics and Where We Are Today//Laboratory Medicine.-2012.-Volume 43.-Issue 2.-P. 41–44.
- Lippi G., Dimundic A.M., Mattiuzzi C. Overview on patient safety in healthcare and laboratory diagnostics //Biochemia Medica. — 2010; 20:131-143.
В
ходе лабораторных исследований возможны
ошибки. Окончательный результат каждого
определения состоит
из
действительных величин и определенной
ошибки исследования, являющейся его
составной частью. Оценка достоверности
результата и его клиническая оценка
требуют знания видов ошибок, которые
могут возникать в течение исследования.
Ошибки клинических исследований можно
классифицировать следующим образом:
—
ошибка предшествующая исследованию;
—
аналитическая ошибка (лабораторная);
—
ошибка интерпретации.
1.
Ошибка перед проведением исследования.
Эта ошибка
охватывает группу факторов, которые
связаны с подготовкой больного к
обследованию, с забором и хранением
материала до начала анализа.
Факторы, приводящие к ошибке перед проведением исследования
-
при
подготовке пациента к исследованию:
нестандартное время суток, неучтённые
диета или приём лекарств и т.д.; -
при
заборе материала: недостаточная
асептика, неправильно подготовленная
посуда для материала, гемолиз крови и
т.д.; -
при
хранении материала: время, температура,
стерильность, раздельное хранение
различных образцов.
2.
Аналитическая ошибка (лабораторная).
Эта ошибка
связана с ходом исследования биологического
материала в лаборатории. Выделяют
несколько видов такой ошибки.
Систематическая
ошибка (точность) выражает
разницу между полученной и действительной
величинами. Источником систематической
ошибки являются особенности метода
или способы его реализации.
В
процессе лабораторных исследований
выявляют постоянно повторяющуюся
неточность. Она может касаться каждого
этапа процесса (производство
идентификаторов, приготовление и
определение стандарта) или может быть
связана с лабораторным оборудованием.
Примером
систематической ошибки метода может
быть определение концентрации глюкозы
по методу Хагедорна-Енсена. Этот метод
базируется на редуцирующих свойствах
глюкозы. Другие присутствующие в крови
вещества, имеющие редуцирующие свойства,
также принимают участие в реакции.
Поэтому результат определения глюкозы
этим методом будет завышенным.
Случайная
ошибка (повторяемость)
характеризует воспроизводимость
результатов между параллельными пробами
в данных условиях.
3.
Ошибка интерпретации результата.
Использование единичного результата
лабораторного анализа при диагностике
заболевания или мониторинге во время
лечения могут быть источником
многочисленных ошибок. Например,
физиологические колебания некоторых
показателей являются иногда довольно
значительными и могут влиять на
клиническую интерпретацию полученного
результата. Эти изменения могут быть
циклическими: часовые, дневные, сезонные.
В таких случаях требуется проведение
дополнительных исследований.
При
интерпретации результата всегда
необходимо учитывать
влияние употребляемых лекарств.
Существует два основных механизма
такого влияния.
Первый
механизм состоит во взаимодействии
лекарств или их продуктов с исследуемым
материалом и реактивами для анализа.
Второй
механизм состоит в фармакологическом
действии лекарств на организм пациента,
которые приводит к изменениям биохимических
показателей, не связанным с болезнью.
Таким
образом, каждый этап биохимического
исследования может быть источником
ошибки. Устранение основных причин
ошибок помогает свести их к минимуму и
позволяет грамотно интерпретировать
результаты анализов, а следовательно,
правильно использовать полученную
информацию для выявления, профилактики
и лечения заболеваний.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #

