Как рассчитать экспериментальную ошибку в химии
На чтение 1 мин. Просмотров 387 Опубликовано 05.06.2021
Ошибка – это мера точности значений в вашем эксперименте. Важно уметь вычислить экспериментальную ошибку, но есть несколько способов ее вычислить и выразить. Вот наиболее распространенные способы вычисления экспериментальной ошибки:
Содержание
- Формула ошибки
- Формула относительной ошибки
- Формула процента ошибки
- Пример расчета ошибки
Формула ошибки
В общем, ошибка – это разница между принятым или теоретическое значение и экспериментальное значение.
Ошибка = экспериментальное значение – известное значение
Формула относительной ошибки
Относительная ошибка = ошибка/известное значение
Формула процента ошибки
% Error = относительная ошибка x 100%
Пример расчета ошибки
Допустим, исследователь измеряет массу образца, который должен быть 5,51 грамм. Известно, что фактическая масса образца составляет 5,80 грамма. Рассчитайте погрешность измерения.
Экспериментальное значение = 5,51 грамма
Известное значение = 5,80 грамма
Ошибка = экспериментальное значение – известное значение
Ошибка = 5,51 г – 5,80 грамма
Ошибка = – 0,29 грамма
Относительная ошибка = ошибка/известное значение
Относительная ошибка = – 0,29 г/5,80 г
Относительная ошибка = – 0,050
% Error = относительная ошибка x 100%
% Error = – 0,050 x 100%
% Error = – 5,0%
Как рассчитать экспериментальную ошибку в химии
На чтение 1 мин. Просмотров 262 Опубликовано 05.06.2021
Ошибка – это мера точности значений в вашем эксперименте. Важно уметь вычислить экспериментальную ошибку, но есть несколько способов ее вычислить и выразить. Вот наиболее распространенные способы вычисления экспериментальной ошибки:
Содержание
- Формула ошибки
- Формула относительной ошибки
- Формула процента ошибки
- Пример расчета ошибки
Формула ошибки
В общем, ошибка – это разница между принятым или теоретическое значение и экспериментальное значение.
Ошибка = экспериментальное значение – известное значение
Формула относительной ошибки
Относительная ошибка = ошибка/известное значение
Формула процента ошибки
% Error = относительная ошибка x 100%
Пример расчета ошибки
Допустим, исследователь измеряет массу образца, который должен быть 5,51 грамм. Известно, что фактическая масса образца составляет 5,80 грамма. Рассчитайте погрешность измерения.
Экспериментальное значение = 5,51 грамма
Известное значение = 5,80 грамма
Ошибка = экспериментальное значение – известное значение
Ошибка = 5,51 г – 5,80 грамма
Ошибка = – 0,29 грамма
Относительная ошибка = ошибка/известное значение
Относительная ошибка = – 0,29 г/5,80 г
Относительная ошибка = – 0,050
% Error = относительная ошибка x 100%
% Error = – 0,050 x 100%
% Error = – 5,0%
How to Calculate Experimental Error in Chemistry
Updated on September 08, 2019
Error is a measure of accuracy of the values in your experiment. It is important to be able to calculate experimental error, but there is more than one way to calculate and express it. Here are the most common ways to calculate experimental error:
Error Formula
In general, error is the difference between an accepted or theoretical value and an experimental value.
Error = Experimental Value — Known Value
Relative Error Formula
Relative Error = Error / Known Value
Percent Error Formula
% Error = Relative Error x 100%
Example Error Calculations
Let’s say a researcher measures the mass of a sample to be 5.51 grams. The actual mass of the sample is known to be 5.80 grams. Calculate the error of the measurement.
Experimental Value = 5.51 grams
Known Value = 5.80 grams
Error = Experimental Value — Known Value
Error = 5.51 g — 5.80 grams
Error = — 0.29 grams
Relative Error = Error / Known Value
Relative Error = — 0.29 g / 5.80 grams
Relative Error = — 0.050
% Error = Relative Error x 100%
% Error = — 0.050 x 100%
% Error = — 5.0%
How to Calculate Experimental Error in Chemistry
Updated on September 08, 2019
Error is a measure of accuracy of the values in your experiment. It is important to be able to calculate experimental error, but there is more than one way to calculate and express it. Here are the most common ways to calculate experimental error:
Error Formula
In general, error is the difference between an accepted or theoretical value and an experimental value.
Error = Experimental Value — Known Value
Relative Error Formula
Relative Error = Error / Known Value
Percent Error Formula
% Error = Relative Error x 100%
Example Error Calculations
Let’s say a researcher measures the mass of a sample to be 5.51 grams. The actual mass of the sample is known to be 5.80 grams. Calculate the error of the measurement.
Experimental Value = 5.51 grams
Known Value = 5.80 grams
Error = Experimental Value — Known Value
Error = 5.51 g — 5.80 grams
Error = — 0.29 grams
Relative Error = Error / Known Value
Relative Error = — 0.29 g / 5.80 grams
Relative Error = — 0.050
% Error = Relative Error x 100%
% Error = — 0.050 x 100%
% Error = — 5.0%
протекающие с выделением энергии, называются экзотермическими, с поглощением – эндотермическими.
Все опыты по определению тепловых эффектов химических реакций проводятся в калориметрах различных конструкций, которые представляют собой как можно лучше изолированный от теплообмена с окружающей средой сосуд с мешалкой и термометром. Простейший калориметр состоит из двух стаканов – внутреннего и внешнего; во внутренний стакан опускаются термометр и мешалка. Во всех опытах условно примем плотности растворов равными 1 г/см3, а теплоѐмкости растворов – 4,184 Дж/г·К.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Магний Mg;
2.Гидроксид натрия NaOH;
3.Серная кислота Н2SO4.
Вопросы для допуска к выполнению лабораторной работы:
1.Что называется энтальпией (теплотой) образования химического соединения?
2.Чему равны энтальпии образования простых веществ?
3. Какие термодинамические параметры считаются стандартными?
Опыт №1. Определение теплового эффекта реакции нейтрализации
Реакция нейтрализации является экзотермической, так как происходит с выделением теплоты.
Методика опыта. Во внутренний стакан калориметра наливаем 20 см3 раствора серной кислоты Н2SO4 с молярной концентрацией эквивалентов 1 моль/дм3. Запишите начальную температуру данного раствора. Затем добавляем 20 см3 раствора гидроксида натрия NaOH с молярной концентрацией эквивалентов 1 моль/дм3. Запишите максимальную температуру реакции.
30

В ходе опыта происходит следующая реакция:
Н2SO4 + 2 NaOH = Na2SO4 + 2 H2O
Тепловой эффект реакции нейтрализации рассчитываем по формуле:
Н 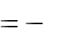
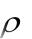 V
V  C
C  t 100
t 100  0,001,
0,001,
где ρ – плотность раствора, г/см3; V – объѐм раствора, см3;
С – удельная теплоѐмкость раствора, Дж/г·К; t – разность температур, °С;
100 – коэффициент пересчѐта на один моль взятой кислоты; 0,001 – коэффициент пересчѐта Дж в кДж.
Запишите расчѐт теплового эффекта реакции нейтрализации по вышеуказанной формуле.
Запишите расчѐт теоретического значения теплового эффекта реакции нейтрализации Нтеор по первому следствию из закона Гѐсса: сначала в общем виде, а затем с подставленными табличными значениями энтальпий образования веществ (см. приложение Б).
Относительную ошибку опыта рассчитываем по формуле:
|
Х |
Нтеор |
Нопытн |
100% |
||||
|
Н |
, |
||||||
|
теор |
|||||||
|
где Нтеор – теоретическое значение величины теплового эффекта, кДж; |
|||||||
|
Нопытн |
– значение величины теплового эффекта, полученное |
||||||
|
в ходе опыта, кДж. |
|||||||
|
Запишите |
расчѐт |
величины |
относительной |
ошибки опыта |
|||
|
по вышеуказанной формуле. |
|||||||
|
Сделайте |
вывод о |
тепловом |
эффекте |
реакции |
нейтрализации |
и укажите, с какой ошибкой он был найден в данном случае.
31

Опыт №2. Определение теплового эффекта реакции взаимодействия металла с кислотой
Реакция взаимодействия металла с кислотой является экзотермической, так как происходит с выделением теплоты.
Методика опыта. Во внутренний стакан калориметра помещаем небольшое количество гранулированного магния Mg и наливаем 2,5 см3 раствора серной кислоты H2SO4 с молярной концентрацией эквивалентов 1 моль/дм3.
Запишите, чему была равна температура кислоты на момент начала реакции и какая максимальная температура была достигнута
входе реакции.
Входе опыта происходит следующая реакция:
Mg + H2SO4 = MgSO4 + H2↑
Тепловой эффект реакции взаимодействия металла с кислотой рассчитываем по формуле:
Н 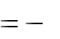
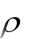 V
V  C
C  t
t  800
800  0,001,
0,001,
где ρ – плотность раствора кислоты, г/см3; V – объѐм раствора кислоты, см3;
С – удельная теплоѐмкость раствора, Дж/г·К; t – разность температур, °С;
800 – коэффициент пересчѐта на один моль взятой кислоты; 0,001 – коэффициент пересчѐта Дж в кДж.
Запишите расчѐт теплового эффекта реакции взаимодействия металла с кислотой по вышеуказанной формуле.
Запишите расчѐт теоретического значения теплового эффекта реакции взаимодействия металла с кислотой Нтеор по первому следствию из закона Гѐсса: сначала в общем виде, а затем с подставленными табличными значениями энтальпий образования веществ (см. приложение Б).
Относительную ошибку опыта рассчитываем по формуле:
32

|
Х |
Нтеор |
Нопытн |
100% |
|||||
|
Н |
, |
|||||||
|
теор |
||||||||
|
где Нтеор – теоретическое значение величины теплового эффекта, кДж; |
||||||||
|
Нопытн |
– значение величины теплового эффекта, полученное |
|||||||
|
в ходе опыта, кДж. |
||||||||
|
Запишите |
расчѐт |
величины |
относительной ошибки опыта |
|||||
|
по вышеуказанной формуле. |
Сделайте вывод о тепловом эффекте реакции взаимодействия металла с кислотой и укажите, с какой ошибкой он был найден в данном случае.
Вопросы для защиты лабораторной работы:
1. Что такое энтальпия (тепловой эффект) химической реакции?
2. Как называются химические реакции, протекающие с выделением теплоты?
3. Как называются химические реакции, протекающие с поглощением теплоты?
4. Формулировка закона Гѐсса.
5. Первое следствие из закона Гѐсса.
6. Как рассчитать тепловой эффект реакции по значениям энтальпий образования вступающих в реакцию и образующихся веществ?
7. Второе следствие из закона Гѐсса.
Рекомендуемая литература:
1.Н.Л. Глинка. «Общая химия». Главы «Превращения энергии при химических реакциях», «Термохимия», «Термохимические расчеты», «Термодинамические величины. Внутренняя энергия и энтальпия», Стандартные термодинамические величины. Химико-термодинамические расчеты».
2.Е.М. Рыбалкин, О.Ю. Ковалик. «Химия. Учебное наглядное пособие». Глава «Химическая термодинамика».
33
3. П.Г. Пермяков, М.Х. Ахметов, С.В. Зенцова. «Основные закономерности протекания химических процессов в газообразных и конденсированных системах. Учебное пособие». Глава «Химическая термодинамика».
4. Р.М. Белкина, Р.И. Славкина, В.Ф. Горюшкин. «Энергетика химических процессов. Задания для практических занятий».
Лабораторная работа №7
Электролитическая диссоциация
Электролитическая диссоциация – это процесс распада электролита на ионы в растворах и расплавах.
Все электролиты делятся на сильные и слабые. Сильные электролиты практически полностью диссоциируют на ионы. Диссоциация слабых электролитов – процесс обратимый, в растворах слабых электролитов устанавливается равновесие между ионами и недиссоциированными молекулами.
|
Отношение |
числа молекул электролита, |
распавшихся |
на ионы, |
|
|
к общему числу |
растворенных |
молекул, |
называется |
степенью |
|
диссоциации электролита. Сила |
кислот |
и |
гидроксидов |
связана |
|
со степенью их диссоциации: чем больше |
степень диссоциации, тем |
|||
|
сильнее соответствующая кислота или гидроксид. |
Химические взаимодействия в растворах электролитов записывают в виде ионно-молекулярных уравнений. Правило составления таких уравнений состоит в следующем: все малорастворимые, летучие вещества
ислабые электролиты записывают в виде молекул, а сильные, легко растворимые – в виде ионов. Обязательным условием протекания ионообменных процессов является удаление из раствора тех или иных ионов, например, вследствие образования слабодиссоциирующих веществ
ивеществ, выделяющихся из раствора в виде осадка или газа.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Гидроксид калия КOH;
2.Гидроксид кальция Са(ОН)2;
34
3.Фосфорная кислота Н3РО4;
4.Соляная кислота HCl;
5.Карбонат натрия Na2CO3;
6.Карбонат кальция СаСО3;
7.Нитрат калия KNO3;
8.Сульфат натрия Na2SO4;
9.Хлорид аммония NH4Cl;
10.Хлорид кальция CaCl2;
11.Хлорид бария ВаCl2;
12.Хлорид кобальта CoCl2;
13.Хлорид меди CuCl2;
14.Индикатор фенолфталеин.
Вопросы для допуска к выполнению лабораторной работы:
1.Какие вещества являются электролитами?
2.Вещества каких классов неорганических соединений относятся
кэлектролитам?
3. Что такое электролитическая диссоциация?
4. Что такое катионы и анионы?
5. Что такое степень электролитической диссоциации?
6. Что такое константа электролитической диссоциации?
7. Какие реакции относятся к ионообменным?
Опыт №1. Диссоциирующее действие воды
Вода оказывает диссоциирующее действие на молекулы веществ; его можно обнаружить, например, в том случае, если молекулы в спиртовом растворе, где они находятся в недиссоциированном состоянии, и ионы в водном растворе имеют различную окраску.
Методика опыта. В пробирку наливаем 2 мл спиртового раствора хлорида кобальта CoCl2 и добавляем 2 мл дистиллированной воды. Окраска раствора изменяется с синей на розовую.
Составьте уравнение диссоциации хлорида кобальта.
Сделайте вывод о данном способе обнаружения диссоциирующего действия воды.
35
Опыт №2. Действие одноимѐнного иона на диссоциацию гидроксида кальция
В растворах слабых электролитов увеличение концентрации одного из ионов данного электролита уменьшает степень диссоциации электролита.
Методика опыта. В пробирку наливаем 2-3 мл раствора гидроксида кальция Са(ОН)2 и добавляем каплю индикатора фенолфталеина; раствор окрашивается в красный цвет. Затем добавляем 2 мл раствора хлорида кальция CaCl2; окраска фенолфталеина ослабевает. Для сравнения проведем аналогичный опыт, добавив вместо раствора хлорида кальция такое же количество воды, чтобы убедиться, что простое разбавление раствора не вызывает такое ослабление окраски.
Сделайте вывод о влиянии одноимѐнного иона на диссоциацию слабого электролита.
Опыт №3. Сравнение химической активности кислот
Методика опыта. В одну пробирку наливаем 3 мл раствора соляной кислоты HCl, в другую – такое же количество раствора фосфорной кислоты Н3РО4. В обе пробирки вносим по одинаковому кусочку мела (карбоната кальция СаСО3). Наблюдается выделение газообразного вещества, которое более бурное и продолжительное в пробирке с раствором соляной кислоты.
Составьте уравнение взаимодействия карбоната кальция с соляной кислотой в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Составьте уравнение взаимодействия карбоната кальция с фосфорной кислотой в молекулярном и ионно-молекулярном виде.
Сделайте вывод, какая кислота более сильная.
Опыт №4. Сравнение химической активности гидроксидов
Методика опыта. В две пробирки наливаем по 3 мл раствора хлорида меди CuCl2 и добавляем в одну 2 мл раствора гидроксида калия КOH, а в другую 2 мл насыщенного раствора гидроксида
36
кальция Са(ОН)2. В первой пробирке выпадает голубой осадок, во второй наблюдается незначительное помутнение раствора.
Составьте уравнение взаимодействия хлорида меди с гидроксидом калия в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Составьте уравнение взаимодействия хлорида меди с гидроксидом кальция в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Сделайте вывод, какой гидроксид более сильный.
Опыт №5. Ионообменные процессы
Ионообменные процессы протекают до конца в случае выпадения осадка, выделения газообразного вещества или образования слабого электролита.
|
Методика опыта. |
|
|
А) В пробирку наливаем 2-3 |
мл раствора хлорида бария ВаCl2 |
|
и добавляем небольшое количество |
раствора сульфата натрия Na2SO4 |
до выпадения осадка сульфата бария белого цвета.
Составьте уравнение взаимодействия хлорида бария с сульфатом натрия в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
Б) В пробирку наливаем 2-3 мл раствора карбоната натрия Na2CO3 и добавляем 1-2 мл раствора соляной кислоты HCl. Наблюдается выделение газообразного вещества.
Составьте уравнение взаимодействия карбоната натрия с соляной кислотой в молекулярном, а также полном и сокращѐнном ионномолекулярном виде.
В) В пробирку наливаем 2-3 мл раствора хлорида аммония NH4Cl и добавляем такое же количество раствора гидроксида калия КOH. Ощущается характерный запах аммиака.
37
Составьте уравнение взаимодействия хлорида аммония с гидроксидом калия в молекулярном, а также полном и сокращѐнном ионно-молекулярном виде.
Г) В пробирку наливаем 2-3 мл раствора нитрата калия KNO3 и добавляем такое же количество раствора сульфата натрия Na2SO4. Изменений не наблюдается.
Сделайте вывод об условиях протекания ионообменных процессов.
Вопросы для защиты лабораторной работы:
1. Чем объясняется электропроводность растворов электролитов?
2. Какое значение имеет вода в процессе электролитической диссоциации?
3. Почему водопроводная вода проводит электрический ток, а дистиллированная нет?
4. Чем отличаются ионы, содержащиеся в кристаллической решѐтке вещества, от ионов, содержащихся в растворе этого же вещества?
5. Чем различаются сильные и слабые электролиты?
6. В молекулах каких электролитов (сильных или слабых) ионы связаны прочно, а в каких слабо?
7. Чему равна степень диссоциации сильных и слабых электролитов? 8. От чего зависит степень электролитической диссоциации?
9. Как можно увеличить или уменьшить степень диссоциации слабого электролита?
10. От чего зависит константа электролитической диссоциации?
11. В каких случаях ионообменные реакции протекают необратимо? 12. Как составляются ионно-молекулярные уравнения?
Рекомендуемая литература:
1.Н.Л. Глинка. «Общая химия». Главы «Теория электролитической диссоциации», «Процесс диссоциации», «Степень диссоциации. Сила электролитов», «Константа диссоциации», «Свойства кислот, оснований
исолей с точки зрения теории электролитической диссоциации», «Ионномолекулярные уравнения», «Смещение ионных равновесий».
2.Е.М. Рыбалкин, О.Ю. Ковалик. «Химия. Учебное наглядное пособие». Главы «Растворы электролитов. Электролитическая диссоциация», «Ионно-молекулярные уравнения реакций».
38
3.П.Г. Пермяков, С.В. Зенцова. «Истинные растворы неэлектролитов и электролитов. Методические указания и контрольные задания». Глава «Свойства растворов электролитов».
4.Р.М. Белкина, С.В. Зенцова. «Растворы. Методические указания». Главы «Электролиты и неэлектролиты», «Ионные уравнения».
5.Р.И. Славкина. «Химия. Методические рекомендации». Глава «Ионные уравнения».
Лабораторная работа №8
Гидролиз солей
Гидролиз – это взаимодействие вещества с водой, при котором составные части вещества соединяются с составными частями воды. При этом образуется молекула или ион слабого электролита и изменяется реакция среды.
Гидролизу могут подвергаться соли, в составе которых есть катион или анион, соответствующий слабому гидроксиду или слабой кислоте. Соли, образованные сильными гидроксидами и сильными кислотами, гидролизу не подвергаются, так как ни один из ионов соли не будет связывать молекулы воды с образованием слабого электролита.
Протекает гидролиз в основном только по первой ступени. Для процессов гидролиза так же можно записывать ионно-молекулярные и сокращѐнные ионные уравнения, руководствуясь общими правилами записи ионообменных процессов.
Для данной лабораторной работы вам потребуются следующие реактивы:
1.Карбонат натрия Na2CO3;
2.Гидрокарбонат натрия NaНСO3;
3.Сульфат алюминия Al2(SO4)3;
4.Сульфит натрия Na2SO3;
5.Хлорид алюминия AlCl3;
6.Хлорида цинка ZnCl2;
7.Хлорид олова SnCl2;
8.Индикатор фенолфталеин;
9.Индикатор лакмус.
39
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
При оценке правильности или воспроизводимости результатов необходимо различать понятия об абсолютной и относительной ошибках. Абсолютной ошибкой называют разницу в абсолютных цифрах между полученным результатом и истинным (или наиболее достоверным) или средним значением. Относительной ошибкой называют отношение обычно в процентах) абсолютной ошибкой к истинному или среднему) значению. [c.480]
Абсолютная и относительная ошибки…………………………….465 [c.495]
Абсолютная и относительная ошибки [c.480]
АБСОЛЮТНАЯ И ОТНОСИТЕЛЬНАЯ ОШИБКИ [c.452]
Решение. Пределы расхода реактива 30 0,4 мл. Среднее арифметическое измерений N = 30. Максимальная ошибка измерений 0,4. Абсолютная и относительная ошибки измерений (при N = 30) [c.38]
По объему, плотности и процентной концентрации раствора рассчитывают содержание в нем сухой соли и ее процентное содержание в исходной смеси. Результат проверяют у преподавателя, находят абсолютную и относительную ошибки определения. Данные опыта и результаты записывают по форме [c.41]
Абсолютная и относительная ошибка. Абсолютная ошибка е при определении массы представляет собой разность между истинной массой В и массой , полученной опытным путем [c.15]
Вычислите молекулярный вес Мсо, тремя способами,- указанными в начале описания работы. Определите абсолютную и относительную ошибки опыта. [c.38]
Определение плотности вещества проведите не менее трех раз, а затем вычислите среднее значение рэ(ср.). После этого найдите справочное значение плотности вещества рв (см. Приложение 2) и рассчитайте абсолютную и относительную ошибку измерения плотности — так же, как для определения пикнометрическим методом. [c.98]
Найти значение титра с учетом только достоверных цифр наблюдения, абсолютную и относительную ошибки определения, а также измерение с наиболее существенной ошибкой. [c.28]
При анализе образца технического хлорида бария получены следующие значения содержания хлора (%) 29,08 29,15 29,31 29,10 29,12. Рассчитайте абсолютную и относительную ошибку для каждого результата. Выявите грубые погрешности. [c.196]
Абсолютные и относительные ошибки расчетов покрытий [c.103]
Рассчитать значение х по приведенным данным и определить абсолютную и относительную ошибку расчета. [c.19]
Результаты сдайте преподавателю. Вычислите абсолютную и относительную ошибки. Абсолютная ошибка е представляет собой разность между истинной величиной В и величиной, полученной в опыте Ь) [c.24]
Абсолютная и относительная ошибки в измерении константы равновесия определяются формулами [c.168]
Затем рассчитывают Кср, а потом абсолютную и относительную ошибки. [c.800]
Вывести уравнение для расчета абсолютной и относительной ошибки при измерении длины волны в зависимости от ошибок измерения Дг, Да, Дй, [c.31]
Находят /Сер, абсолютную и относительную ошибки. [c.792]
Найти абсолютную и относительную ошибки измерения и измерение с наиболее существенной ошибкой. [c.28]
Находят Кср И сравнивают со значением к, полученным из графика. Рассчитывают абсолютную и относительную ошибки. [c.797]
По разности вз—найти массу двуокиси углерода в колбе (вв) Из найденных весов и определить относительную плотность двуокиси углерода по воздуху и вычислить молекулярный вес (с точностью до 0,01). Определить абсолютную и относительную ошибки опыта. [c.33]
По опытным данным вычислить молекулярный вес кислорода с точностью до 0,01 и определить абсолютную и относительную ошибки. [c.33]
Найти значение Сд , абсолютную и относительную ошибку измерения. Ответ С =6,54-10 вд.=0,8%. [c.29]
Вычислите абсолютную и относительную ошибки опыта Абсолютная ошибка = 5теор С- [c.88]
Для оценки точности измерения вычисляют абсолютную и относительную ошибки конечного результата. Абсолютная ошибка есть разность между теоретическим значением величины Ь и значением величины с, полученным в опыте [c.37]
Найдите абсолютную и относительную ошибки определения. Результаты сдайте преподавателю. [c.28]
Сравните значение энтальпии растворения АЯэ, полученное экспериментально, с табличным значением (Приложение 11), рассчитайте абсолютную и относительную ошибку. С чем связано отклонение полученной величины от табличного значения ДЯ растворения [c.61]
Какая связь между абсолютной и относительной ошибками опыта [c.29]
Абсолютная и относительная ошибки. Ошибка может бь выражена абсолютным или относительным значением. [c.216]
Определить абсолютную и относительную ошибку опыта [c.35]
В этой таблице приведены данные для условии (высокое давление, низкая температура), при которых следует ожидать максимальную ошибку при определении состава газа для принятого в справочнике диапазона изменения параметров процесса конверсии углеводородов. Из таблицы следуе , что абсолютные и относительные ошибки для наименее благоприятного случая невелики. Следовательно, для практических расчетов справочные таблицы вполне пригодны. [c.12]
Вычислите абсолютную и относительную ошибки определения (см. с. 166). [c.212]
Абсолютные и относительные ошибки [c.12]
Абсолютную и относительную ошибки расчета по этому уравнению вычисляют по формулам, приведенным в табл. 3. Для величины у—по формулам (П1) и (И1а) [c.22]
Определение абсолютной и относительной ошибки непосредственного измерениякакой-нибудь величины [c.11]
По полученным данным рассчитать содержание окиси меди в исходной соли (в %). По формуле Си2(ОН)2СОз вычислить содержание окиси меди в осповном карбонате меди и сравнить экспериментально полученный результат с теоретическим. Определить абсолютную и» относительную ошибку (в %). [c.45]
Значение к рассчитывают по (Х111. 136), а также графически— на основании зависимости 1п(1 оо—V) от t. Вычисляют J p, абсолютную и относительную ошибку. [c.782]
Порядки реакций рассчитывают по формулам (ХП1. 141) и (XIII. 142). Полученные значения ос и р округляют до ближайшего целого положительного числа, подставляют в (XIII. 138) и рассчитывают константу скорости. Находят /Сср, абсолютную и относительную ошибки. Сравнивают стехиометрические коэффициенты со значениями порядков. Учитывая механизм реакции, дают объяснение значениям аир. [c.785]
Константу скорости рассчитывают по формуле (XIII. 168). На основании полученных данных находят Кср, а также абсолютные и относительные ошибки. [c.804]
Для вычисления абсолютной п относительной ошибок определения расчленяем форк улу на составляющие, как это указано выше, и после несложных преобгагсЕзь пй находим выражения для абсолютной и относительной ошибки [c.24]
How to Calculate Experimental Error in Chemistry
Updated on September 08, 2019
Error is a measure of accuracy of the values in your experiment. It is important to be able to calculate experimental error, but there is more than one way to calculate and express it. Here are the most common ways to calculate experimental error:
Error Formula
In general, error is the difference between an accepted or theoretical value and an experimental value.
Error = Experimental Value — Known Value
Relative Error Formula
Relative Error = Error / Known Value
Percent Error Formula
% Error = Relative Error x 100%
Example Error Calculations
Let’s say a researcher measures the mass of a sample to be 5.51 grams. The actual mass of the sample is known to be 5.80 grams. Calculate the error of the measurement.
Experimental Value = 5.51 grams
Known Value = 5.80 grams
Error = Experimental Value — Known Value
Error = 5.51 g — 5.80 grams
Error = — 0.29 grams
Relative Error = Error / Known Value
Relative Error = — 0.29 g / 5.80 grams
Relative Error = — 0.050
% Error = Relative Error x 100%
% Error = — 0.050 x 100%
% Error = — 5.0%
to continue to Google Sites
Not your computer? Use Guest mode to sign in privately. Learn more
Не пойму, что я делаю не правильно:
p.s. по лабораторной работе «определение теплоты нейтрализации»
Чтобы найти относительную погрешность опыта надо: е = (Qтеорит-Qэксп)/Qтеорит * 100%
Qтеорит = 56,9 кдж/моль, а Qэксп я нашла , получилось 1161,4 Дж и перевела в килоджоули 1,1614 кДж.
Но когда я их подставляю в формулу, у меня получается значение 98!
Такое может быть? Или где-то ошибка?
